La energía, la temperatura y el movimiento son tres magnitudes que, en esencia, determinan el funcionamiento del Universo. En este sentido, todo lo que sucede en el Cosmos puede entenderse como un proceso determinado por las leyes universales de la termodinámica. Los intercambios de temperatura y los flujos de energía rigen el comportamiento de la naturaleza.
La termodinámica es la rama de la Física que estudia las propiedades macroscópicas de la materia afectada por todos aquellos fenómenos relacionados con el calor. Y esto abarca desde el ciclo de vida de las estrellas hasta cómo se deshace un hielo en un vaso de agua.
Y de entre todas las magnitudes físicas que esta disciplina maneja, una de las más importantes es, sin duda, la entalpía. La variación en esta propiedad termodinámica es la que determina que las reacciones químicas dentro de un sistema sean exotérmicas (liberen calor) o endotérmicas (absorban calor), algo muy importante en muchos ámbitos científicos.
Pero, ¿qué es exactamente la entalpía? ¿Cómo se calcula? ¿Qué tipos existen? ¿Cómo se relaciona con la entropía? En el artículo de hoy responderemos a estas y muchas otras preguntas acerca de esta energía que, aunque no lo veamos, determina la naturaleza de todo lo que nos rodea.
- Te recomendamos leer: “¿Qué es la entropía?”
¿Qué es la entalpía?
La entalpía, representada como H, es la cantidad de energía que un sistema termodinámico, en condiciones de presión constantes, intercambia con el medio que lo rodea. En otras palabras, es una propiedad termodinámica cuya variación determina si la reacción química en cuestión libera energía en forma de calor o necesita absorber esta energía calorífica.
Por lo tanto, la entalpía puede entenderse como la cantidad de energía calorífica que un sistema termodinámico (regido por los flujos de temperatura y energía) emite o absorbe cuando está a una presión constante. Y por sistema termodinámico podemos entender, básicamente, cualquier objeto físico.
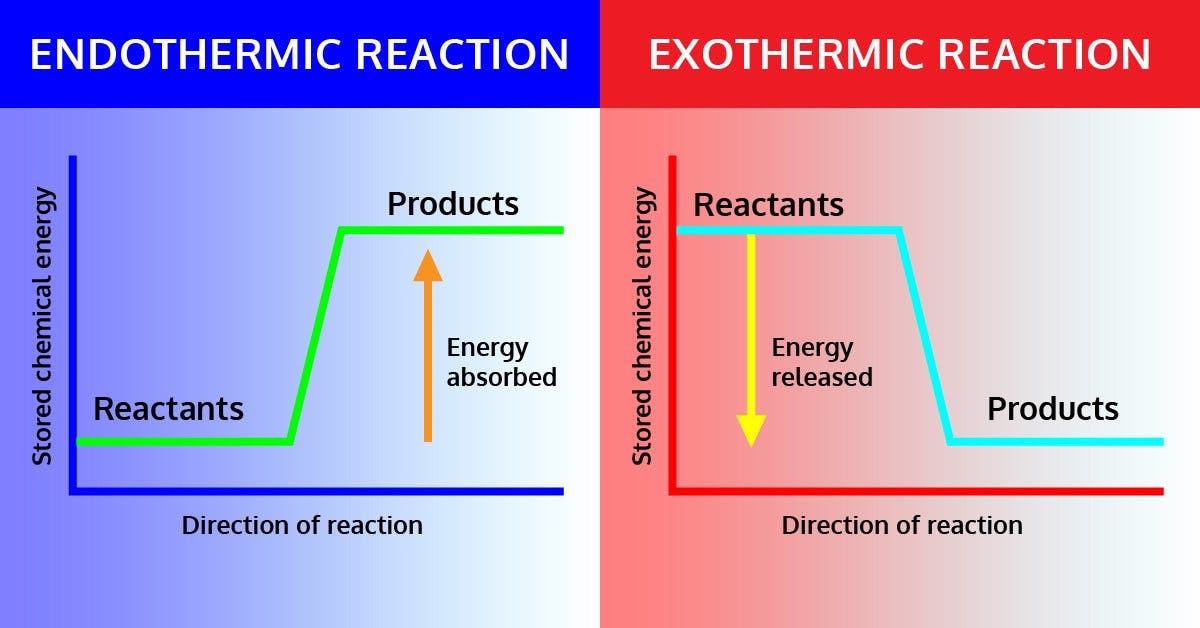
Se trata de una de las propiedades termoquímicas más fundamentales, pues estamos analizando cómo el medio de reacción intercambia calor (ya se absorbiéndola o liberándola) con el medio que lo rodea. Y que la absorba o que la libere estará determinado no por la entalpía en sí (H), sino por la variación de la misma (ΔH). Y en función de esto, una reacción química puede ser de dos tipos:
-
Exotérmica: Cuando ΔH < 0 (la variación de entalpía es negativa), la reacción libera energía en forma de calor. No consumen calor, sino que la emanan. Todas las reacciones en las que el producto final sea molecularmente más sencillo que el inicial serán exotérmicas.
-
Endotérmica: Cuando ΔH > 0 (la variación de entalpía es positiva), la reacción consume energía en forma de calor. No liberan energía, sino que tienen que absorberla y gastarla. Todas las reacciones en las que el producto final sea molecularmente más complejo que el inicial serán endotérmicas.
En resumen, la entalpía (o la variación de entalpía) es una energía cuyo valor determina si una reacción química específica, en unas condiciones constantes de presión, liberará energía calorífica (exotérmica) o absorberá la energía en forma de calor (endotérmica). La unidad del sistema internacional para la entalpía son los Joules (J).
- Te recomendamos leer: “Las 4 leyes de la termodinámica (características y explicación)”
¿Cómo se calcula la entalpía?
Como hemos visto, el fundamento de la entalpía es muy sencillo. Si su variación es negativa, la reacción química en cuestión liberará energía calorífica al medio. Y si su variación es positiva, absorberá energía en forma de calor. Ahora bien, ¿cómo podemos calcularla? Muy sencillo también.
La fórmula para calcular la entalpía es la siguiente:
H = E + PV
Donde:
- H: Entalpía (medida en Joules)
- E: Energía en el sistema (medida también en Joules)
- P: Presión (medida en Pascales)
- V: Volumen (medido en metros cúbicos)
En Química, el producto PV (presión multiplicada por volumen) es igual al trabajo mecánico aplicado al sistema termodinámico (puede representarse como W). Por lo tanto, podemos dar con otra definición de entalpía. La entalpía es el resultado de la suma entre la energía de un sistema termodinámico y el trabajo mecánico que aplicamos en él.
Aun así, como hemos dicho, lo que de verdad nos interesa para determinar cómo se comportará térmicamente la reacción es la variación de entalpía. Por ello, nos encontramos con esta nueva fórmula:
ΔH = ΔE + PΔV
Todo se calcula de acuerdo a su variación (entalpía final - entalpía inicial, energía final - energía inicial, volumen final - volumen inicial) excepto la presión, pues ya hemos dicho que una condición indispensable para los cálculos de entalpía es que la presión dentro del sistema debe mantenerse constante.
En resumen, si el resultado de sumar la variación de energía al producto de la presión por la variación de volumen es positivo, significa que la entalpía aumenta y, por lo tanto, entra energía calorífica en el sistema (es endotérmica). Si, por el contrario, el resultado de esa suma es negativa, significa que la entalpía disminuye a lo largo de la reacción y, por lo tanto, sale energía calorífica del sistema (es exotérmica).

¿Qué tipos de entalpía existen?
Ya hemos visto exactamente qué es la entalpía y cómo se calcula. Ahora toca ver cómo se clasifica en función de la naturaleza de las reacciones químicas que determina y de cómo se juega con la energía calorífica en las mismas.
1. Entalpía de formación
La entalpía de formación queda definida como la cantidad de energía necesaria para formar un mol de un compuesto (la unidad con la que se mide la cantidad de una sustancia y que es equivalente a 6,023 x 10^23 átomos o moléculas de compuesto) a partir de los elementos que lo constituyen en unas condiciones de temperatura y presión estándares, es decir, 25 °C y 1 atmósfera, respectivamente.
2. Entalpía de descomposición
La entalpía de descomposición queda definida como la cantidad de energía calorífica absorbida o liberada cuando un mol de una sustancia se desintegra en sus elementos constituyentes.
3. Entalpía de combustión
La entalpía de combustión es aquella vinculada a la quema de sustancias en presencia de oxígeno. En este sentido, se trata de la energía liberada cuando un mol de una sustancia es quemado. La sustancia en cuestión arde al reaccionar con el oxígeno y son reacciones exotérmicas, pues se libera siempre calor y luz.

4. Entalpía de hidrogenación
La entalpía de hidrogenación queda definida como la energía liberada o absorbida cuando a una sustancia le añadimos una molécula de hidrógeno, para formar generalmente un hidrocarburo.
5. Entalpía de neutralización
La entalpía de neutralización queda definida como la energía liberada o absorbida cuando se mezcla un ácido (pH por debajo de 7) y una base (pH por encima de 7), las cuales terminan neutralizándose. De ahí su nombre. Siempre que una sustancia ácida y una básica se mezclen, habrá una entalpía de neutralización asociada a la reacción.
6. Entalpía de cambio de fase
Por entalpía de cambio de fase entendemos cualquier liberación o absorción de energía cuando un mol de una sustancia concreta modifica su estado de agregación. En otras palabras, es la energía asociada al cambio de estado entre el líquido, el sólido y el gaseoso.
7. Entalpía de disolución
La entalpía de disolución queda definida como la energía absorbida o liberada cuando una sustancia química se disuelve en una solución acuosa. Es decir, es la energía vinculada a una mezcla entre un soluto y un solvente, teniendo una fase reticular (absorbe energía) y una de hidratación (libera energía).
8. Entalpía de fusión
La entalpía de fusión es la variación en la energía de un sistema cuando la sustancia química involucrada pasa del estado sólido al líquido, como por ejemplo cuando un hielo se deshace.
9. Entalpía de vaporización
La entalpía de vaporización es la variación en la energía de un sistema cuando la sustancia química involucrada pasa del estado líquido al gaseoso, como por ejemplo cuando el agua hierve en la olla.

10. Entalpía de sublimación
La entalpía de sublimación es la variación en la energía de un sistema cuando la sustancia química involucrada pasa del estado sólido al gaseoso sin pasar por el líquido, como por ejemplo la evaporación de los polos terrestres, con un agua que pasa directamente del hielo a la atmósfera, sin pasar por el estado líquido.
11. Entalpía de solidificación
La entalpía de solidificación es la variación en la energía de un sistema cuando la sustancia química involucrada pasa del estado líquido al sólido, como por ejemplo cuando el agua líquida se congela y obtenemos hielo.
¿Cómo se relaciona la entalpía con la entropía?
La entalpía y la entropía son dos términos que suelen confundirse entre sí. Y aunque estén relacionados (como veremos ahora), son bastante diferentes. Como hemos visto, la entalpía es la energía que un sistema termodinámico intercambia con el medio que lo rodea.
La entropía, en cambio, es justo lo contrario. Y aunque sea incorrecto definirla como la magnitud que mide el grado de desorden en un sistema, sí es cierto que está relacionada con la energía no disponible en la reacción. Por lo tanto, de cierta manera sí que está vinculada con el caos molecular.
Sea como sea, entalpía y entropía están relacionadas. Pero, ¿de qué manera? Bueno, lo cierto es que es bastante complejo, pero lo podríamos resumir en que siguen una relación inversamente proporcional: a mayor entalpía (más intercambio de energía), menor entropía (menos desorden); mientras que a menor entalpía (menos intercambio de energía), mayor entropía (más desorden).
















