Los principios de la termodinámica rigen el Universo. Cualquier cuerpo u objeto imaginable está regulado y limitado por las leyes universales de la termodinámica, una rama de la Física que describe el comportamiento de la energía, la temperatura y el movimiento, tres magnitudes que, de acuerdo a estos principios, están estrechamente relacionados.
Como venimos diciendo, estas leyes explican el comportamiento de gran parte de los procesos que ocurren en el Cosmos en los que hay intercambio de materia y energía entre distintos cuerpos. Y no hablamos de estrellas ni de agujeros negros (que también), sino que nosotros mismos estamos regidos por estos principios.
Los seres humanos conseguimos energía mediante la ingesta de alimentos y después usamos esta energía para, por ejemplo, caminar. Todos los procesos de la naturaleza en los que hay un intercambio de energía pueden ser explicados mediante una de las cuatro leyes de la termodinámica.
Por ello, y con el objetivo de entender exactamente qué es la termodinámica y cuál es su importancia a la hora de comprender las leyes físicas del Universo, presentaremos estos cuatro principios de forma sintetizada y clara.
- Te recomendamos leer: “Las 3 leyes de Newton (características y explicación)”
¿Qué es la termodinámica?
El concepto de “termodinámica” procede del griego “thermos” (calor) y “dynamos” (fuerza). Este origen léxico ya nos da una pista de cuál es el objeto de estudio de esta disciplina. En efecto, la termodinámica es una rama de la Física estudia todos aquellos fenómenos que suceden en los cuerpos afectados por los intercambios de temperatura y por el flujo de energía, cosa que determina directamente su movimiento.
En otras palabras, la termodinámica es la disciplina física que estudia las propiedades macroscópicas (visibles al ojo humano, aunque sea de forma indirecta) de la materia afectada por fenómenos relacionados con el calor. Y es que la temperatura determina la circulación de la energía y esta induce movimiento.
Esta ciencia, además de, como veremos, dar respuesta a cómo suceden gran parte de los procesos del Universo, tiene infinidad de aplicaciones en nuestra vida. Y es que sabiendo cómo ocurren las transformaciones de energía, podemos obtener muchos beneficios.
Es decir, partiendo de la energía calorífica (estudiada por la termodinámica), que puede venir, por ejemplo del Sol, podemos convertir esta energía en una energía mecánica capaz de mover (de ahí lo de “movimiento”) máquinas. Y esta energía mecánica, a su vez, puede convertirse en energía eléctrica, capaz de satisfacer nuestras necesidades. Como vemos, los distintos tipos de energía están estrechamente relacionados.
- Para saber más: "Los 21 tipos de energía (y sus características)"
Si no estuvieran tan vinculadas y las transformaciones no fueran posibles, tampoco sería posible que sucedieran los fenómenos que rigen la naturaleza del Universo. Desde la formación de estrellas hasta el desarrollo de la vida, pasando por la circulación de aire por la atmósfera, las reacciones químicas, el aumento y disminución de la temperatura, hervir agua…
Y son precisamente estas cuatro leyes de la termodinámica las que, matemáticamente, explican cómo la temperatura, la energía y el movimiento no solo están vinculadas entre ellas, sino con los otros tipos de energía.
¿Cuáles son los principios de la termodinámica?
La termodinámica es una disciplina física que tiene sus orígenes en la mitad del siglo XVII, cuando se descubrió que existía una correlación entre la presión a la que se sometía un gas y la temperatura del mismo. Sin embargo, los principios o leyes de esta ciencia no llegarían hasta bastante tiempo después.
Cada ley se formuló en tiempos distintos. La primera en hacerse (que fue la segunda) se ideó en el año 1824, aunque volvería a reformularse 40 años después. Durante años siguieron estudiándose las leyes termodinámicas de los sistemas materiales (líquidos, sólidos, gases…), consiguiendo, en el año 1930, la formulación de la última ley, conocida como “ley cero”.
Entendido el contexto y qué es, a grandes rasgos, la termodinámica, podemos pasar a ver sus leyes. Recordemos que cualquier proceso del Universo en el que haya un intercambio de temperatura entre cuerpos y un flujo de energía, está regido por alguno de los siguientes principios.
Ley “cero”: Principio del equilibrio térmico
“Si un sistema A y un sistema B están a la misma temperatura y B está a la misma temperatura que C, entonces A y C están a la misma temperatura”.
Este enunciado, que a primera vista puede parecer excesivamente lógico, encierra un principio muy importante para comprender cómo fluye la temperatura entre cuerpos. Y es que entra en juego el conocido como equilibrio térmico.
Este concepto hace referencia a cómo dos cuerpos con temperaturas distintas en contacto (A y C) o separados por una superficie conductora (B), transfieren calor del uno al otro hasta que las temperaturas, que inicialmente eran diferentes, se igualan.
Es decir, si ponemos en contacto dos cuerpos y uno está más caliente que el otro, la transferencia de calor hará que se llegue al equilibrio térmico, un estado en el que la temperatura de ambos objetos es igual y, mientras en el sistema no entre un tercer cuerpo con calor distinto, la temperatura se mantendrá constante.
Muchos procesos de nuestro día a día están regidos por este principio. Por ejemplo, los congeladores basan su funcionamiento en esta ley. Nosotros ponemos los alimentos (a temperatura ambiente) en el congelador, que es muy frío. Este congelador es un sistema en el que el alimento y el aire helado intercambian calor hasta que se iguala. Cuando se llega al equilibrio térmico, la comida está a la misma temperatura que el aire.

Primera ley: Principio de conservación de la energía
“La energía ni se crea ni se destruye. Solo puede transformarse o transferirse de un objeto a otro”.
Este tan conocido enunciado es la primera ley de la termodinámica, la cual afirma que la cantidad total de energía en el Universo no ha cambiado desde su origen. Lo único que puede hacer la energía es transformarse (por ejemplo, pasar de energía química a mecánica) o transferirse de un cuerpo a otro, como hemos visto con la temperatura en la ley cero.
- Quizás te interese: "Los 10 materiales y objetos más densos del Universo"
Todos los procesos físicos del Universo se plasman en esta ley. Desde las luces de nuestra casa transformando la energía eléctrica en energía lumínica hasta las plantas convirtiendo la energía lumínica en energía química, pasando por nuestras células, que convierten la energía química en energía mecánica.
Sin embargo, este principio también defiende que ningún proceso de transformación de energía es 100% eficiente. Es decir, en ningún sistema del cosmos se consigue que una energía de tipo A se transforma absolutamente toda en una energía de tipo B. Siempre hay una parte de energía que se “pierde”. Y lo decimos entre comillas porque realmente no se pierde, sino que simplemente se libera.
Y se libera en forma de calor. Todas las reacciones de transformación de energía generan calor como “efecto secundario”, de ahí que este principio forme parte de la termodinámica. Es decir, si las luces de nuestra casa fueran 100% efectivas (es físicamente imposible que lo sean), toda la energía eléctrica se transformaría en lumínica. Pero siempre hay pérdidas en forma de calor.
Y esto pasa con todos los procesos imaginables. La energía térmica siempre es la fracción energética que se genera debido a que las transformaciones no son plenamente efectivas. Pero es precisamente este calor el que permite que se cumpla la ley de conservación de la energía.
Segunda ley: Principio de la entropía
“La cantidad de entropía en el Universo tiende a incrementarse con el tiempo”.
La entropía es una magnitud física que mide el grado de desorden de un sistema. Pues bien, esta ley de la termodinámica afirma que, a medida que pasa el tiempo, la entropía tiende a aumentar inevitablemente, es decir, que se incrementa el grado de desorden en el Universo.
Antes de entrar en profundidad en conceptos más físicos, entendamos qué significa esto. Este principio nos dice que absolutamente todo en el Universo tiende al desorden conforme avanza el tiempo. Piensa en tu habitación. A medida que pasan los días, si sigues con tu día a día normal, ¿a qué tiende? ¿A ordenarse? ¿O a desordensarse? Claramente a desordenarse. Y no porque no seas una persona limpia. Cuando te digan lo contrario, puedes decir que simplemente eres víctima de la segunda ley de la termodinámica.
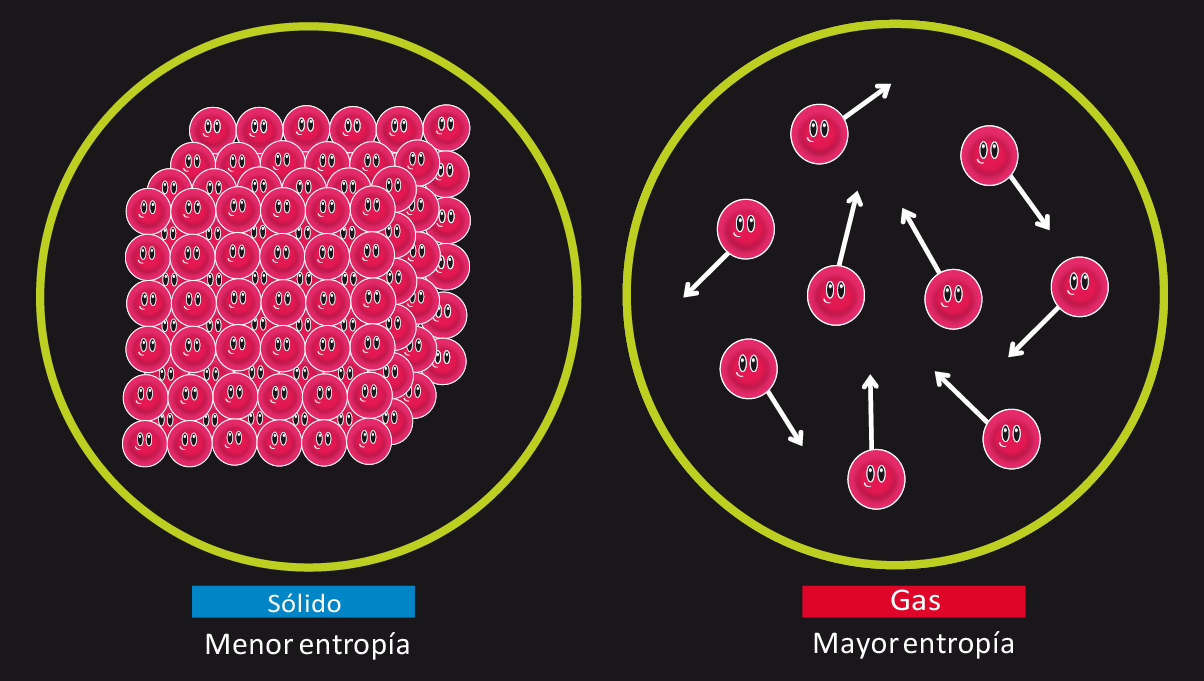
Después de haber hecho una metáfora de lo que significa este aumento de la entropía, llevémoslo al terreno más físico. ¿Por qué esta tendencia al desorden? Para responder a ello, debemos regresar a la segunda ley, que nos decía que en todas las reacciones de transformación de energía, una parte se perdía en forma de calor.
Es decir, en todas y cada una de las reacciones que ha habido en el Universo desde el Big Bang hasta hoy (desde estrellas explotando a tú caminando por la playa), una parte de la energía no se ha destinado al trabajo en cuestión, sino que se ha perdido en forma de energía calorífica.
Pero, ¿qué pasa con esta energía? No puede simplemente “flotar”. No. Lo que hace es, por lo que nos decía la ley cero, transferirse entre los cuerpos. Es decir, las temperaturas, recordemos, tienden a igualarse. Recordemos también que, cuanto mayor sea la temperatura, mayor será el movimiento de las moléculas en la materia, ya sea sólida, líquida o gaseosa.
Por lo tanto, cuando un cuerpo pierde calor al transformar energía, tiene que igualarse con los cuerpos de su alrededor. Y al igualarse las temperaturas, inevitablemente, se tiende al desorden, pues hacemos que los cuerpos fríos (con más orden ya que las moléculas se mueven lentamente) empiecen a aumentar su entropía, pues su temperatura se incrementa y, con ello, el movimiento de las partículas. A más movimiento, más desorden.
Y este desorden es irreversible por simple estadística. Hay muchísimas configuraciones que consideramos “desordenadas” pero muy pocas que consideramos “ordenadas”. Si tú quemas un trozo de madera, la tendencia de las cenizas no será la de volver a unirse, ¿verdad? Es estadísticamente imposible que ocurra.
Tercera ley: Principio de Nernst
“Al llegar al cero absoluto de temperatura, cualquier proceso físico se detiene”.
Esta tercera ley, que recoge la información de todas las anteriores, parte de la base de que para que haya cualquier reacción de transformación de energía (lo que el enunciado expresa como proceso físico) es necesario que haya movimiento de partículas.
Por lo tanto, si llegamos al cero absoluto de temperatura (0 K o -273.15 °C), no puede ocurrir ningúna reacción energética. Y es que a esta temperatura, que es la más baja posible, las moléculas que conforman la materia están tan increíblemente juntas (físicamente no pueden estarlo más) que no puede darse ningún proceso físico. Porque todos ellos dependen de la temperatura, y si esta llega al cero absoluto, las reacciones se anulan.
De igual modo, el principio dice que, llegados a esta temperatura, la entropía llega al valor mínimo constante. Es imposible un grado mayor de orden. Las moléculas están totalmente juntas y no se mueven absolutamente nada.
De todos modos, se cree que es imposible llegar al cero absoluto. De hecho, el lugar más frío del Universo es la Nebulosa Boomerang, situada a 5.000 años luz de nosotros, donde se ha descubierto que las temperaturas son de -272 °C, pero sigue sin ser el cero absoluto.

















