Toda la materia del Universo está compuesta de átomos, los cuales conforman uno de los niveles más bajos de organización de la materia. De hecho, todo aquello más pequeño deja de cumplir las leyes de la física tradicional, pues entramos en el mundo de las partículas subatómicas e incluso de la famosa Teoría de Cuerdas, una hipótesis que defiende que la naturaleza fundamental de la materia son hilos unidimensionales en vibración.
Sea como sea, durante mucho tiempo se creyó que los átomos eran la unidad indivisible de materia. Y esto, a pesar de que se ha demostrado que, en efecto, los átomos están formados por estructuras más pequeñas, nos ha servido para entender la naturaleza del Cosmos en su escala más pequeña.
Pero, ¿cómo de pequeña? Muchísimo. Tanto que un simple grano de arena podrían caber más de 2 millones de millones de átomos. Estas unidades compuestas por un núcleo alrededor del cual giran electrones hacen posible la existencia no solo de materia, sino de todas las leyes que rigen el comportamiento y funcionamiento del Universo.
Por ello, y con el objetivo de entender exactamente qué es un átomo, en el artículo de hoy analizaremos su estructura, detallando todas las partes por las que está formado. Protones, neutrones, electrones, partículas subatómicas… Hoy aprenderemos acerca de todo esto.
- Te recomendamos leer: “¿Qué es la Teoría de Cuerdas? Definición y principios”
¿Qué es un átomo?
Esta pregunta aparentemente sencilla entraña más complicación de la que parece. Y es que definir un átomo no es tan fácil. La definición más clara es la de que un átomo es la unidad más pequeña en la que se puede obtener materia estable, es decir, manteniendo las propiedades de un elemento químico en cuestión.
En esencia, un átomo es uno de los niveles más bajos de organización de la materia y, como vemos, es el nivel más bajo en el que la materia está estable, pues las partículas subatómicas, excepto en casos puntuales, no pueden existir por sí solas, es decir, tienen que unirse entre ellas.
En este sentido, imaginemos nuestro cuerpo. Si vamos tirando cada vez hacia lo más pequeño, veremos que nuestro organismo está formado por órganos, los cuales, a su vez, están formados por tejidos. Estos tejidos, por células. Estas células, por macromoléculas (ADN, proteínas, carbohidratos, grasas…). Estas macromoléculas, por moléculas. Y estas moléculas, por átomos.
Por lo tanto, podríamos definir el átomo de una forma menos científica pero útil para entenderlo como cada una de las piezas que conforman el puzzle de las moléculas, que son el esqueleto de toda la materia del Universo.
Todos visualizamos el átomo como un núcleo grande alrededor del cual giran unas pequeñas partículas que son los electrones, como si de un sistema solar en miniatura se tratara. Es decir, hay un centro (el núcleo) alrededor del cual giran los distintos planetas (los electrones) siguiendo órbitas bien definidas. Sin embargo, este modelo está obsoleto. Hoy en día sabemos que la realidad no es así y que cuando llegamos a niveles tan bajos, las cosas no suceden como en el mundo que percibimos. Más adelante veremos cómo es, en realidad, un átomo.
- Para saber más: “Los 19 niveles de organización de la materia”
Átomo y elemento químico: ¿quién es quién?
Antes hemos comentado que el átomo es la unidad más pequeña de materia que mantiene estables las propiedades de un elemento químico, pero, ¿qué significa exactamente esto? Vayamos paso a paso, porque es imprescindible entender bien la relación átomo - elemento antes de continuar.
Todos hemos visto la famosa tabla periódica de los elementos alguna vez. En ella, aparecen los, por ahora, 118 elementos químicos descubiertos. En ella, aparecen todos los elementos químicos ordenados (ahora veremos en base a qué), encontrándonos con absolutamente todos los ingredientes de la materia conocida en el Universo.
Absolutamente todo aquello que existe, desde nuestro cuerpo hasta una estrella, es una combinación de distintos elementos. Hidrógeno, oxígeno, carbono, litio, hierro, oro, mercurio, plomo… Cada uno de estos elementos químicos tiene unas propiedades únicas e interacciona con otros de formas distintas.
Pero, ¿qué tienen que ver los átomos en todo esto? Pues, básicamente, todo. Y es que un elemento químico es, en esencia, un átomo con un número concreto de protones. Y de esto es lo que depende el elemento y el modo en el que se ordenan.
Dependiendo del número de protones en el núcleo, estaremos ante un elemento u otro. Un elemento X es todo aquel átomo en el Universo que tiene un número determinado de protones en su núcleo. Cada elemento tiene un número atómico (número de protones en el núcleo) único.
Así, el hidrógeno, el elemento más ligero y abundante del Universo, tiene un solo protón en el núcleo (además de un neutrón y un electrón si está en la forma estable). Si añadimos otro (las reacciones de fusión nuclear que suceden en el interior de las estrellas permiten unir núcleos de átomos para dar lugar a elementos cada vez más pesados), tendríamos helio, que tiene número atómico 2.
Y así hasta el oganesón, que, con sus 118 protones en el núcleo, es el elemento (y átomo) más pesado. De hecho, solo los 94 primeros existen de forma natural. Del 94 al 118 solo se han conseguido sintetizar en laboratorios y tienen “vidas” muy cortas.
Por poner algunos ejemplos, el elemento oxígeno es todo aquel átomo con 8 protones en el núcleo. El carbono, con 6. El hierro, con 26. La plata, con 47.
En resumen, es el número de protones en el núcleo (el de neutrones y el de electrones suele ser igual al de protones, para igualar cargas eléctricas, pero esto lo analizaremos después) lo que determina las propiedades del átomo. Un átomo que, como veremos, independientemente del elemento en cuestión, tiene siempre una estructura que varía muy poco.
¿Cuál es el modelo atómico actual?
Como comentábamos anteriormente, la visión tradicional del átomo corresponde a un modelo antiguo que está obsoleto. Y a pesar de que sirva para comprender su estructura, debemos, al menos, presentar el modelo actual, el cual está basado en las leyes de la mecánica cuántica.
Evidentemente, esto complica las cosas, pues en el mundo subatómico, una partícula (como un electrón) puede estar en varios sitios a la vez. Y estará en uno o en otro dependiendo de nosotros, que somos el observador. Para nosotros, esto no tiene ningún sentido, pero estamos en el mundo subatómico. Y ahí las cosas no tienen las mismas propiedades que en nuestro mundo. El gran reto de la Física actual es, precisamente, unificar todas las leyes en una sola y conectar, por fin, el mundo cuántico con el de la relatividad general.
Más allá de esto, lo importante del modelo actual es que dice que el átomo está prácticamente vacío, es decir, que la imagen típica de un núcleo grande con los electrones cerca no es así. El núcleo representa solo una milésima parte del tamaño del átomo, pero alberga el 99,99% de su masa.
Imaginemos que un átomo es algo del tamaño de un campo de fútbol. Pues bien, mientras que los electrones serían algo del tamaño de una cabeza de alfiler por las esquinas, el núcleo sería como una pelota de tenis en el centro del campo. Están increíblemente alejados pero, incluso así, se atraen. Pero, ¿por qué partes está formado un átomo? Veámoslo.

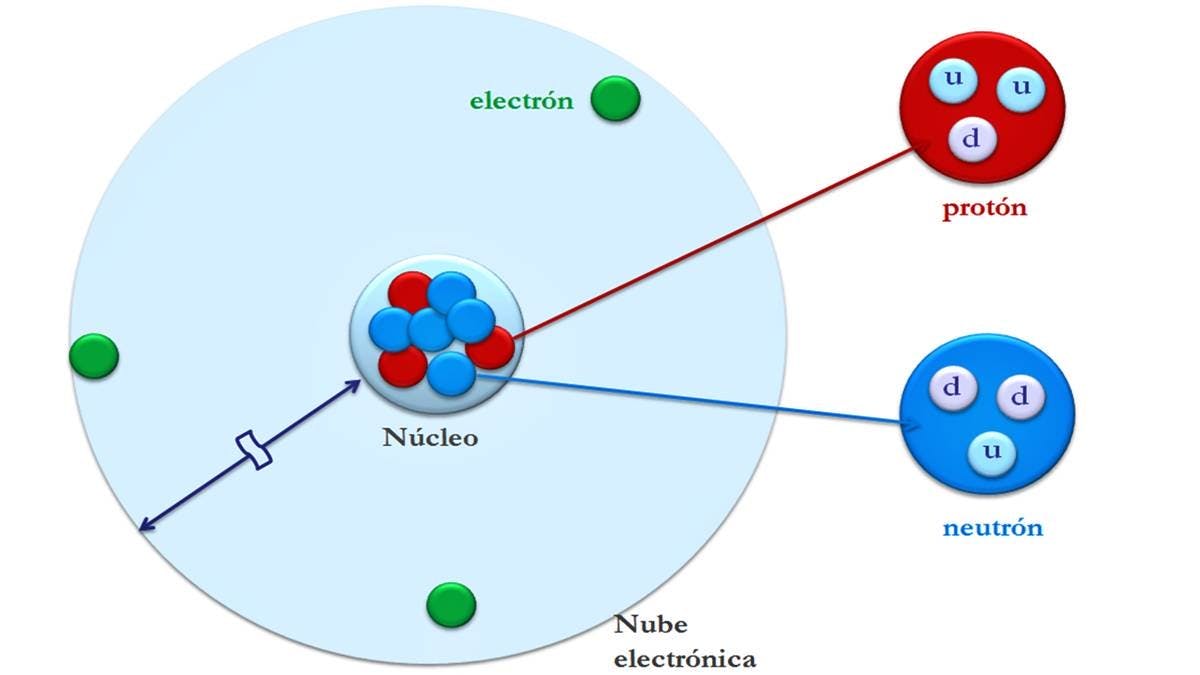
1. Protones
El protón es una partícula subatómica compuesta de otras partículas subatómicas elementales (los quarks) que, junto con los neutrones, conforma el núcleo del átomo. De hecho, los protones y los neutrones están increíblemente unidos por unas fuerzas muy intensas, tanto que, para separarlos, hay que bombardear el núcleo con otros neutrones, consiguiendo que el núcleo se rompa (se separen protones y neutrones), liberando así enormes cantidades de energía. La energía nuclear se basa precisamente en esto.
Sea como sea, el protón es una partícula subatómica con carga positiva y una masa 2.000 veces más grande que la de un electrón. En condiciones normales, el número de protones es igual al de neutrones y de electrones. Como hemos comentado, es el número de protones lo que determina el elemento químico. Si se ganan o se pierden (ambos procesos requieren de muchísima energía) protones en el núcleo, se cambia de elemento.
Los protones, pues, son las partículas cargadas positivamente y que albergan gran parte de la masa, conformando, junto con los neutrones, el núcleo del átomo, es decir, el centro. Están unidos por la fuerza nuclear fuerte, que es cien veces más intensa que la electromagnética.
- Quizás te interese: “Los 21 tipos de energía (y sus características)”
2. Neutrones
El neutrón es una partícula subatómica compuesta de otras partículas subatómicas elementales (los quarks) que, junto con los protones, conforma el núcleo del átomo. Son muy similares a los protones en el sentido que tienen una masa prácticamente igual a la de estos, aunque se diferencian en que los neutrones no tienen carga eléctrica.
Aunque esto tiene que puntualizarse. Y es que todas las partículas subatómicas tiene carga eléctrica, pues es una propiedad intrínseca. Lo que sucede es que las tres partículas de quarks que componen el neutrón tienen unas cargas eléctricas que se compensan entre ellas, es decir, se igualan a 0. Por lo tanto, el neutrón no es que no tenga carga, sino que sus tres cargas se igualan, por lo que, como su propio nombre indica, quedan neutras.
El número de neutrones en el núcleo no determina el elemento, pero sí que suele ser igual al de protones. Cuando se ganan o se pierden neutrones en el núcleo del átomo, estamos ante lo que se conoce como isótopo, que son variantes más o menos estables del elemento en cuestión.
Los neutrones, pues, son partículas sin carga eléctrica y una masa igual que la de los protones, junto a los que constituye el núcleo del átomo.
3. Electrones
Con los electrones, la cosa se complica. Y es que ya no son partículas subatómicas compuestas. Los electrones son partículas subatómicas elementales (no están formadas por la unión de otras partículas subatómicas, como sí pasaba con los protones y neutrones), por lo que entramos ya de pleno en la física cuántica y las cosas suceden de forma extraña.
Un electrón es una partícula subatómica elemental 2.000 veces más pequeña que un protón. De hecho, tiene un tamaño de, aproximadamente, un attómetro, que son 10 elevado a -18 metros. Como bien sabemos, es una partícula con carga eléctrica negativa.
- Te recomendamos leer: “Las 31 unidades de distancia (y para qué sirven)”
Y es precisamente esta carga negativa lo que hace que orbite alrededor del núcleo del átomo, el cual, recordemos, tiene una carga positiva (los protones son positivos y los neutrones, neutros, así que el núcleo queda positivo).
Como hemos comentado, está increíblemente alejado del núcleo, por lo que prácticamente todo el átomo es espacio literalmente vacío, sin ninguna partícula. Sea como sea, está “unido” al núcleo por la fuerza electromagnética, la cual es cien veces menos intensa que la nuclear, que es la que, como hemos visto, mantiene pegados los protones y los neutrones.
Los electrones orbitan alrededor del núcleo siguiendo trayectorias que, de acuerdo al modelo actual, no tienen nada que ver con los planetas orbitando a una estrella. No siguen órbitas definidas y, de hecho, vemos que se comportan tanto como una onda como una partícula. Esto que, a priori, no tiene ningún sentido, está siendo estudiado por la física cuántica.
















