La teoría cinética de la materia se puede resumir en un solo párrafo: la materia es discontinua, pues está formada por moléculas, una serie de agrupaciones definidas de átomos. Entre estas moléculas hay un espacio vacío, y estas interaccionan entre ellas mediante fuerzas de cohesión.
Si acudimos a la revisión bibliográfica referente a este conglomerado terminológico, sorprende observar que la mayoría de estudios actuales se centran en la comunicación de la teoría a las generaciones estudiantiles y no en sus fundamentos en sí mismos. Estamos ante un concepto que se da por sentado por su irrefutabilidad, por lo que el mayor problema a día de hoy es hacer entender este tipo de conceptos abstractos a la población general.
Muchos de nosotros hemos entrado en contacto con la teoría cinética durante el periodo estudiantil, pues es un paso obligado en cualquier curso de química básica. Aun así, ¿sabrías definir con exactitud en qué se basa esta postulación?
Desde luego, las bases sobre las que se asienta la teoría cinético-molecular son mucho más complejas de lo que en un principio se podría creer. Acompáñanos por este viaje en el mundo de la física y la química, pues en la ciencia, dar por sentados conocimientos (por básicos que sean), suele ser uno de los mayores motores de error.
- Te recomendamos leer: "Historia de la Química: evolución e hitos de esta ciencia"
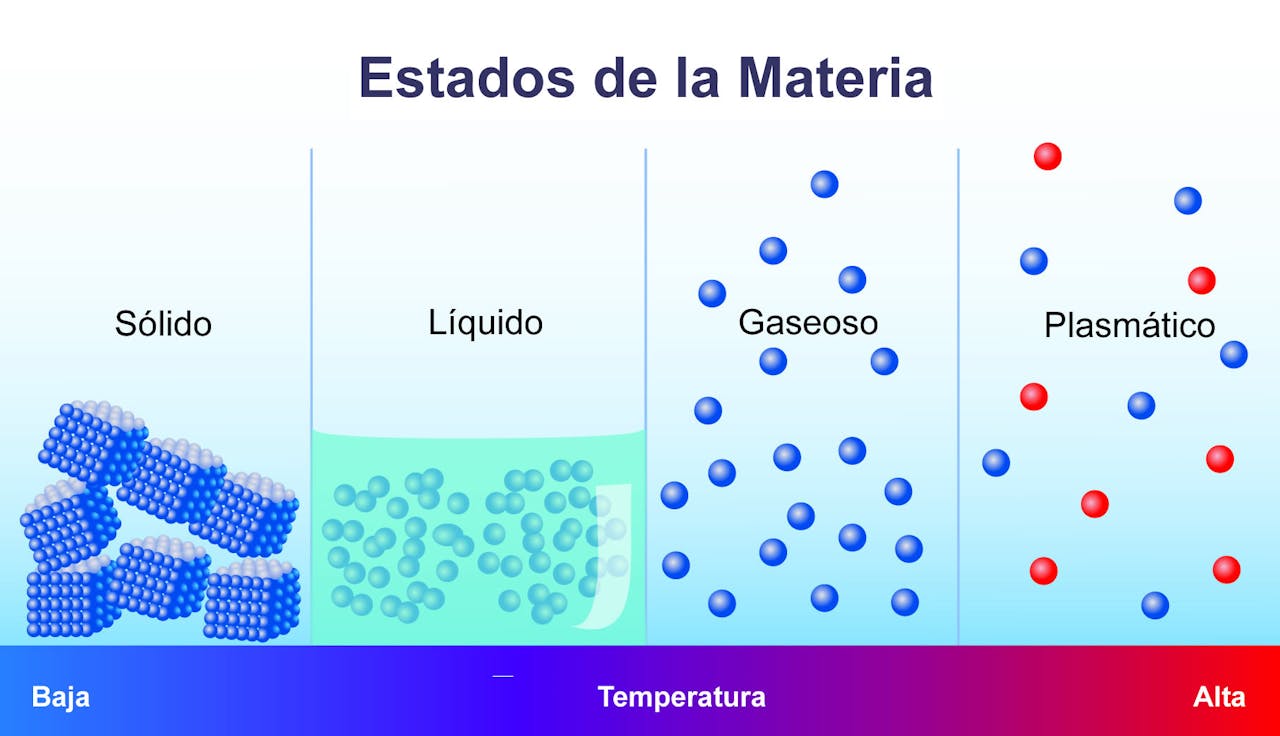
Los cuatro estados de la materia
La teoría cinética no puede ser comprendida si no asentamos una base de conocimiento previa. La materia, comprendida como todo aquello que se extiende en cierta región del espacio-tiempo, puede presentarse en cuatro estados diferentes. Es necesario entender las propiedades de cada uno, aunque sea mediante una explicación sencilla, para proceder con esta incursión en el mundo de la química y la física. Vamos a ello.
- Te recomendamos leer: "Los 10 materiales y objetos más densos del Universo"
1. Estado sólido
Los objetos en estado sólido se presentan en el medio de forma definida, pues sus átomos a menudo se entrelazan formando “redes” estrechas. Por ello, la materia sólida suele caracterizarse por una cohesión elevada, resistencia a la fragmentación y una capacidad de fluir baja o nula. Cuanta menor sea la temperatura, menor será el movimiento de partículas.
- Te recomendamos leer: "Los 10 lugares más fríos del Universo"
2. Estado líquido
El estado líquido es el resultado de aplicar temperatura sobre un objeto sólido, pues este pierde su forma y estructura cristalina en el proceso. Debido a que existe una unión mucho más baja entre los átomos del cuerpo, los líquidos fluyen, no poseen forma definida y son capaces de adaptarse al recipiente en el que se albergan.
3. Estado gaseoso
En tercer lugar tenemos al estado gaseoso, el cual se caracteriza por una agregación molecular no unida y con poca fuerza de atracción. Los gases no tienen volumen ni forma definida, por lo que se expanden libremente hasta ocupar la totalidad del recipiente en el que se contienen. La clave de este medio, como veremos en líneas posteriores, es la libertad de las moléculas que lo conforman.
4. Estado plasmático
Como hemos dicho con anterioridad, dar por sentado conceptos básicos puede inducir a error. Aunque no tan conocido, existe un cuarto estado de la materia: el estado plasmático, el cual se diferencia por sus propiedades de forma clara de los sólidos, líquidos y gases.
Estamos ante un fluido similar al gas, pero en este caso sus moléculas están cargadas eléctricamente. Al estar sus componentes ionizados, el plasma no alcanza un equilibrio electromagnético, y por lo tanto, es un excelente conductor de electricidad. Las estrellas son esferas incadescentes de plasma.
- Te recomendamos leer: "Los 12 lugares más calientes del Universo"
Las bases de la teoría cinética de la materia
Una vez hemos repasado los distintos estados de la materia (con alguna que otra sorpresa), podemos asentar las bases de la teoría que hoy nos atañe en las siguientes afirmaciones:
- La materia está compuesta por partículas (moléculas y, a su vez, átomos) invisibles al ojo humano en continuo movimiento y entre ellas hay un espacio vacío.
- La energía cinética de las partículas de un objeto se incrementa al aumentar su temperatura.
- Las partículas chocan entre sí y con otras superficies de manera elástica, ya que se mueven en todas las direcciones.
Desde luego, estas leyes son mucho más aplicables en el mundo de los gases, y por ello, la teoría cinética de la materia se suele asociar directamente con el estado gaseoso. En un medio sólido las moléculas se encuentran unidas por fuerzas que las mantienen a distancias relativamente pequeñas, por lo que su movimiento está limitado a la vibración, sin que se puedan desplazar.
Es momento de pisar el freno, pues hemos introducido un término que suele darse por sentado en la mayoría de lecciones de esta índole, pero que desde luego requiere de especial mención. ¿Qué es realmente la energía cinética?
Definida de forma clásica como el trabajo necesario para acelerar un cuerpo de una masa determinada desde el reposo hasta la velocidad indicada, podemos decir de forma resumida que la energía cinética es, valga la redundancia, la energía que posee un cuerpo a causa de su movimiento. De forma teórica, un objeto que se encuentra en reposo presentará un coeficiente de energía cinética equivalente a 0. Pero las partículas nunca están quietas. Solo lo están, teóricamente, en el cero absoluto de temperatura (-273'15 °C) y es físicamente imposible alcanzar este frío.
Podríamos pensar que un sólido no posee energía cinética al estar sus partículas estrechamente unidas, pero esto no es del todo así. Por ejemplo, cuando un objeto sólido rígido gira en torno a un eje que pasa por su centro de masas, las partículas que lo conforman escriben un movimiento circular en torno a dicho eje, con una velocidad lineal distinta según sea la distancia de la partícula al eje. Así pues, existen dos tipos de energía cinética: de rotación y de traslación. La materia siempre tiene energía cinética sin importar su estado. Los sólidos tienen una energía baja y los gases, una alta, pero siempre hay energía porque siempre hay movimiento de partículas.
Cinética y gases
De nuevo, es necesario recalcar que la teoría cinética de la materia cobra especial interés ante el medio gaseoso, pues las fuerzas de cohesión impiden que las partículas de los objetos sólidos y líquidos se muevan de forma libre por el medio.
Por ejemplo, cuando se aumenta la temperatura de un cuerpo sólido, el movimiento de las partículas se incrementa (pero solo el vibratorio, ya que no se pueden mover libremente por el espacio), por lo que se puede observar una dilatación del mismo. Cuando se aplica suficiente calor las fuerzas de cohesión disminuyen, lo que hace imposible que las moléculas permanezcan fijas y causa la transformación del sistema material a un líquido.
Por otra parte, los líquidos presentan una mayor plasticidad de movimiento desordenado, así, cuando se aplica suficiente calor sobre ellos (punto de ebullición), las moléculas que lo conforman consiguen romper la tensión superficial y “escapar”, lo que da lugar al estado gaseoso.
Así pues, el grado de movimiento de las partículas de un material es lo que distingue, al menos desde un punto de vista macroscópico, a un sólido, gas o líquido. Esta teoría cinética de gases que los caracteriza como una serie de partículas en libre movimiento ha permitido a los científicos, de forma histórica, describir ciertas propiedades en este estado:
- Los gases ocupan todo el volumen disponible y no presentan una forma fija.
- Se pueden comprimir con muchísima más facilidad que los objetos sólidos y líquidos.
- El volumen, a una presión dada ocupado por un gas es directamente proporcional a su temperatura.
- La presión que ejerce un gas en un volumen dado es directamente proporcional a su temperatura.
- La presión y el volumen son inversamente proporcionales.
Como resumen de todo este conglomerado terminológico, podemos decir que las partículas que conforman los gases, al ser prácticamente independientes (fuerzas de unión muy débiles), se mueven continuamente y con desorden. Cuanta más temperatura se aplique a este sistema tan laxo, más rápido se moverán las partículas y más chocarán entre ellas y con la superficie que las contenga, por lo que aumentará la presión.
Resumen
Como hemos podido ver en estas líneas, la teoría cinética de la materia va mucho más allá de lo que en un principio se podría esperar. Para comprenderla hemos tenido que definir los cuatro estados de la materia, asentar sus bases y aplicarla al terreno que más utilidad reporta: el comportamiento de los gases.
Todo este tipo de conocimiento puede parecernos obvio en una sociedad moderna donde las bases de la física y la química ya han sido asentadas, pero desde luego, para los científicos del siglo XIX, el descubrimiento de este tipo de postulaciones fue todo un hito. De todas formas, recordar estas leyes que aprendimos en un pasado lejano no es una cuestión anecdótica: el repaso del conocimiento pasado disminuye las probabilidades de errores futuros.
















