La materia es todo aquello que tenga masa y que ocupe un volumen en el espacio. Y desde el nivel subatómico hasta observar el Universo como un todo, la materia del Cosmos se organiza en distintos niveles estrechamente relacionados entre ellos.
Durante mucho tiempo, creímos que los átomos eran las unidades más pequeñas de la materia, pues se consideraban indivisibles y extremadamente pequeños. De hecho, un simple grano de arena está compuesto por más de 2 millones de millones de átomos. El mismo número de galaxias que hay en el Universo.
Y, a pesar de que descubrimos que había un nivel inferior (el subatómico), este nivel de partículas subatómicas se regía por unas reglas del juego distintas: las leyes de la mecánica cuántica. Por ello, los átomos, pese a no ser el nivel más bajo de organización de la materia, sí que son la unidad básica de la misma.
Pero, ¿qué relación tienen estos átomos con las moléculas? ¿Son sinónimos? ¿En qué se diferencian? Si quieres encontrar respuesta a estas y muchas otras preguntas acerca de la naturaleza atómica y molecular del Universo, has llegado al lugar adecuado. En el artículo de hoy veremos las principales diferencias entre los átomos y las moléculas.
- Te recomendamos leer: “Los 19 niveles de organización de la materia”
¿Qué son los átomos? ¿Y las moléculas?
Antes de entrar en profundidad a analizar sus diferencias en forma de puntos clave, es interesante (y también importante) entender exactamente qué son los átomos y las moléculas. Por ello, exploremos la naturaleza de estos dos niveles de organización de la materia tan relacionados pero a la vez tan distintos.
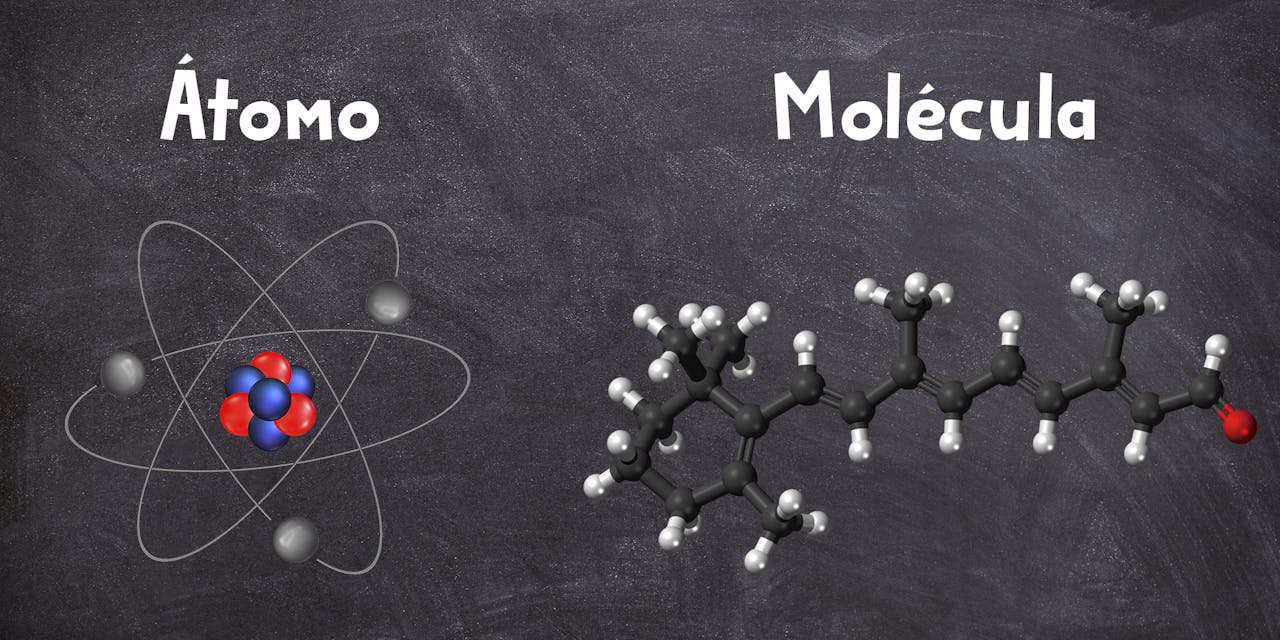
Átomo: ¿qué es?
Un átomo es la unidad más pequeña en la que se puede obtener materia estable, manteniendo las propiedades químicas de un elemento químico en cuestión. En otras palabras, los átomos son cada una de las piezas que conforman el puzzle de las moléculas. Y aquí ya vamos viendo la relación entre ellos.
Todos hemos visto la famosa tabla periódica de los elementos químicos. En ella, aparecen y están ordenados los (por ahora) 118 elementos descubiertos, que son, en esencia, cada uno de los ingredientes de la materia conocida en el Universo.
Todo aquello que existe es una combinación de estos elementos. Cada elemento tiene unas propiedades únicas e interacciona con otros elementos de una forma también única. Pero, ¿qué tienen que ver los átomos con esto? Bueno, básicamente, todo.
Y es que un elemento químico es un átomo con un número concreto de protones. Es decir, dependiendo del número de protones en el núcleo atómico, tendremos un elemento u otro. Así, el hidrógeno, el elemento más ligero y abundante del Cosmos, tiene solo un protón en su núcleo. Si el átomo tiene 6 protones, entonces estamos ante el carbono. Y así con los 118 elementos.
Un átomo, pues, es una estructura que se encuentra al límite del mundo cuántico con un núcleo que representa solo una milésima parte de su tamaño total pero que alberga el 99,99% de su masa. Este núcleo está compuesto por dos tipos de partículas subatómicas: protones y neutrones.
Los protones son partículas subatómicas compuestas (formadas por tres quarks, que son partículas subatómicas elementales) de carga positiva y una masa 2.000 veces más grande que la del electrón. El número de protones determina el elemento químico. Y, en condiciones normales, el número de protones es igual al de neutrones, las otras partículas subatómicas del núcleo atómico y que son similares a los protones con la particularidad de no tener carga eléctrica. Protones y neutrones están pegados entre ellos a través de la fuerza nuclear fuerte.
Y alrededor de este núcleo, tenemos los electrones. Unas partículas subatómicas elementales que orbitan alrededor de los protones y los neutrones siguiendo unas órbitas no definidas, sino que se rigen por los alocados principios de la física cuántica. Un electrón está, de forma simultánea, en todos los lugares donde pueda estar.
Sea como sea, los electrones son partículas 2.000 veces más pequeñas que los protones que tienen carga negativa y que se encuentran unidas al núcleo a través de la fuerza electromagnética (cien veces menos intensa que la nuclear fuerte). Imagina un átomo como algo del tamaño de un campo de fútbol. Pues bien, el núcleo sería una pelota de tenis en el centro del campo y los electrones, la cabeza de un alfiler en una esquina. El 99,99999% del átomo es vacío.
- Para saber más: “Las 3 partes de un átomo (y sus características)”

Molécula: ¿qué es?
Las moléculas son organizaciones de átomos. Es un nivel de organización de la materia superior en el que cada molécula tiene unas propiedades únicas que nacen de las características de los distintos átomos que la conforman y, por lo tanto, de los elementos químicos que la constituyen.
En otras palabras, una molécula es una agrupación definida y ordenada de átomos que constituye la unidad más pequeña de una sustancia pura capaz de conservar sus propiedades. Existen moléculas formadas por un solo átomo (como el helio), pero lo más habitual es que sean combinaciones de dos (como el hidrógeno H2) de tres (H2O), de cuatro (NH3), de cinco (CH4), etc.
La variedad de moléculas en el Universo es simplemente inimaginable. Hay miles de millones de moléculas distintas, pues hay casi infinitas (es un decir) formas en las que los átomos pueden unirse entre ellos y formar enlaces estables. El agua, por ejemplo, es una molécula que nace de la unión, a través de un enlace covalente (el tipo de enlace más fuerte que existe), de dos átomos de hidrógeno y uno de oxígenos.
Cuando estas moléculas están formadas por átomos de, al menos, dos elementos químicos distintos, hablamos de compuesto. Y si, además, uno de estos elementos es el carbono, hablamos de molécula orgánica. Si no tiene carbono, de molécula inorgánica.
Posteriormente, estas moléculas pueden organizarse entre ellas para dar lugar a macromoléculas (como el ADN o las proteínas) necesarias para la existencia de los seres vivos. Y estas macromoléculas se organizan entre ellas para dar células. Y las células para dar tejidos. Y los tejidos, para dar órganos. Y así sucesivamente.
En resumen y de forma más técnica, una molécula es un grupo eléctricamente neutro, un nivel de organización de la materia suficientemente estable que nace de la unión de, como mínimo, dos átomos unidos entre ellos a través de enlaces químicos fuertes.

¿En qué se diferencia un átomo de una molécula?
Después de analizar individualmente ambos conceptos, seguro que las diferencias entre átomos y moléculas han quedado más que claras. De todas formas, por si quieres la información más visual, hemos preparado una selección de las principales diferencias entre ellas en forma de puntos clave.
1. El atómico es un nivel de organización de la materia inferior
El nivel de organización más bajo de la materia es el nivel subatómico. Después de este encontramos el nivel atómico. Y después de este viene el nivel molecular. Como vemos, mientras que el nivel de los átomos es el segundo de los 19 niveles de organización de la materia, el molecular es el tercero. El átomo es un nivel más profundo de estructuración de la materia. Y es que más que nada, los átomos son, como hemos visto, la unidad más pequeña en la que se puede obtener materia estable.
2. Las moléculas son resultado de la unión de átomos
Seguramente, la diferencia más importante. Los átomos son átomos; mientras que las moléculas son conjuntos de átomos. Los átomos son el resultado de la unión, a través de la fuerza nuclear fuerte, de protones y neutrones en un núcleo y de, a través de la fuerza electromagnético, unos electrones orbitando alrededor de este núcleo.
Las moléculas, en cambio, son grupos estables de, como mínimo, dos átomos unidos entre ellos a través de enlaces químicos fuertes. En este sentido, la principal diferencia entre ambos conceptos es que las moléculas están hechas de átomos y los átomos están hechos de partículas subatómicas.
- Te recomendamos leer: “Los 8 tipos de partículas subatómicas (y sus características)”
3. Las moléculas son más grandes que los átomos
Una diferencia muy poco técnica pero que seguro que te ayudará a entenderlo. Y es que las moléculas, al ser resultado de la unión de átomos, son, por lógica, más grandes que estos átomos. El cesio (de número atómico 55) es el elemento químico cuyos átomos son más grandes. Los átomos de cesio tienen un tamaño de 343 picómetros (pm). Un picómetro equivale a la billonésima (un millón de millones) parte de un metro.
En cambio, la molécula más grande jamás sintetizada (la PG5) tiene un tamaño de 10 nanómetros. Un nanómetro es la milmillonésima parte de un metro. La diferencia es, aunque no lo parezca, abismal.
4. La diversidad de átomos es menor que la de moléculas
Realmente, de átomos distintos solo hay 118. Que son los elementos químicos de la tabla periódica. Ahora bien, estos 118 elementos químicos distintos, al poder combinarse entre ellos de formas muy distintas, permiten que la diversidad de moleculas sea inmensa. Sea cree que la diversidad de moléculas podría ser del orden de 160 mil millones, aunque todo son estimaciones. Tenemos registradas unas 90 millones de moléculas distintas.
5. En las moléculas hay enlaces químicos; en los átomos, no
Y para terminar, una diferencia también muy importante. Mientras que las moléculas son el resultado de la unión de átomos a través de enlaces químicos (como el enlace covalente), los componentes de los átomos no se unen entre ellos a través de enlaces. Los protones, neutrones y electrones no establecen enlaces, sino que se mantienen unidos a través de dos de las cuatro fuerzas fundamentales (electromagnetismo y fuerza nuclear fuerte). Es decir, la cohesión en las moléculas se debe a enlaces químicos; la cohesión en los átomos, a las fuerzas elementales.
















