El sistema inmune es una de las máquinas más perfectas de la naturaleza. Un conjunto de órganos, tejidos y células especializadas en un objetivo muy concreto pero esencial para nuestra supervivencia: el reconocimiento y neutralización de amenazas para el organismo. El sistema inmunitario nos protege de los peligros tanto externos como internos, siendo nuestra defensa natural.
A cada instante, millones de patógenos bacterianos, víricos y fúngicos diseñados única y exclusivamente para infectarnos están intentando burlar las defensas de nuestro cuerpo. Y si enfermamos tan poco es porque, en efecto, nuestro sistema inmunitario está diseñado casi a la perfección para detectar y matar a estos seres que intentan hacernos daño.
Y aunque hay muchos protagonistas involucrados en la respuesta inmunitaria, con diferentes células inmunes especializadas en funciones muy concretas dentro de la protección del cuerpo, toda ella se fundamenta en unas proteínas conocidas como anticuerpos que son, sin lugar a dudas, el pilar de la inmunidad.
Y en el artículo de hoy nos centraremos en estas moléculas que, uniéndose específicamente a los antígenos presentes en la membrana de los patógenos que entran en nuestro cuerpo, alertan a las células inmunes para neutralizar la amenaza antes de que esta nos haga enfermar. Veremos exactamente qué son, cómo funcionan y qué clases existen. Empecemos.
- Te recomendamos leer: “Los 8 tipos de antígenos (y su origen)”
¿Qué son los anticuerpos?
Los anticuerpos son proteínas de tipo inmunoglobulina que son sintetizadas por los linfocitos, las células del sistema inmune, como respuesta a la presencia de un antígeno, que es la sustancia o fragmento molecular que, una vez en nuestro cuerpo, es reconocida por los receptores del sistema inmune adaptativo como un peligro que debe ser neutralizado. Los anticuerpos, pues, son los antagonistas de estos antígenos.
En este sentido, cada anticuerpo está diseñado específicamente para unirse a un antígeno concreto, por lo que se diseña “a la carta” del mismo. Y fruto de esta afinidad química que deriva en una unión física, los anticuerpos señalizan el lugar donde se encuentra el germen (o sustancia dañina en general) para que las células inmunes especializadas en destruir a los portadores de estos antígenos puedan realizar su función.
A nivel molecular, los anticuerpos son glucoproteínas (moléculas compuestas por una proteína unida a uno o varios glúcidos) de tipo gamma (nombre que simplemente hace referencia al modo en el que las proteínas se separan cuando se aplican técnicas de laboratorio por electroforesis, que separa las moléculas según su movilidad en un campo eléctrico) globulina (que hace referencia a su estructura globular). En otras palabras, un anticuerpo es una inmunoglobulina, siendo siempre de naturaleza proteica.
Sea como sea, los anticuerpos son proteínas producidas por los linfocitos B, aquellas células inmunes que, siendo originadas en la médula ósea, actúan como fábricas de estos anticuerpos cuando detectan la presencia de un antígeno, el cual, como hemos visto, es sinónimo de peligro que debe ser neutralizado. Y aquí es cuando entran en juego los anticuerpos.
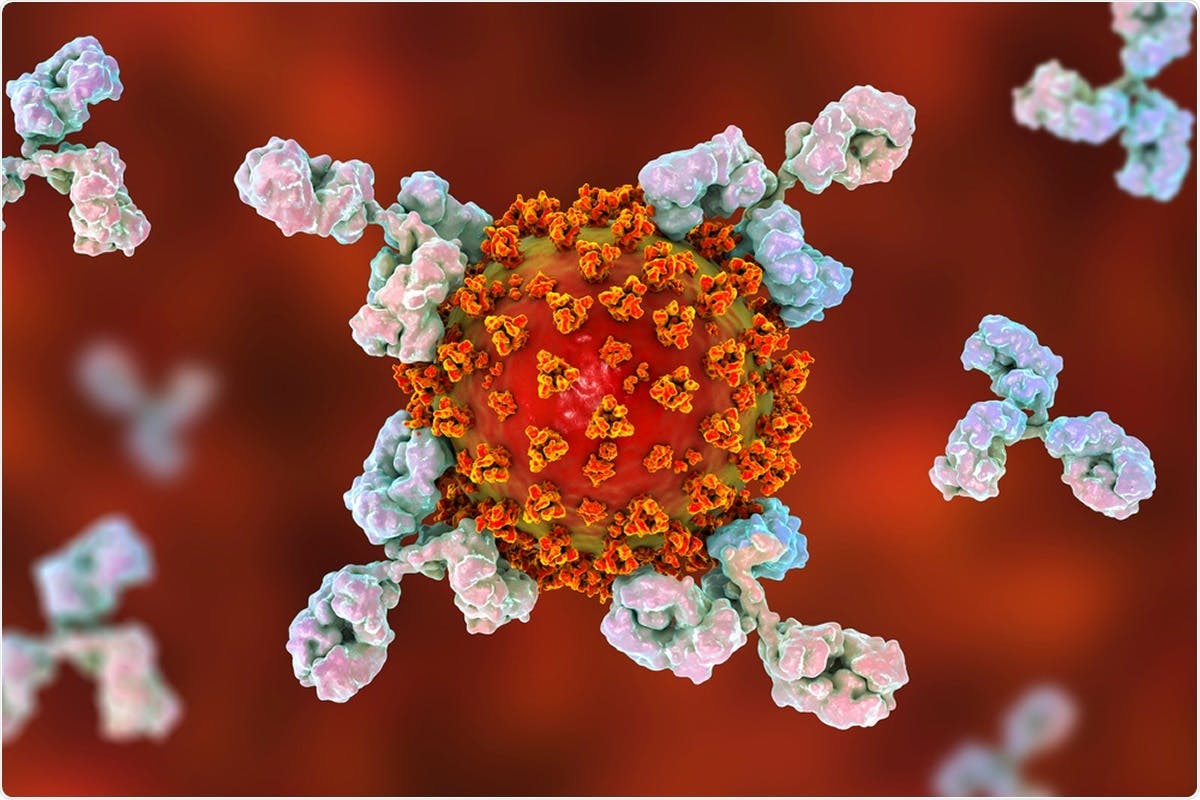
Estos anticuerpos funcionan, en esencia, como “mensajeros”, avisando al resto de linfocitos y células del sistema inmunitario de que en el organismo hay una amenaza que tiene que ser eliminada. Tras su síntesis en masa y posterior unión al antígeno para el que está diseñado, los anticuerpos alertarán a los linfocitos T CD8+, los glóbulos blancos que, en cuanto encuentren al antígeno que está siendo señalizado por el anticuerpo (no pueden reconocer directamente el antígeno, pero sí al anticuerpo que está marcando la “diana”), destruirán al patógeno portador de este antígeno.
Así pues, un anticuerpo es, al final, una molécula proteica que es sintetizada por nuestro propio cuerpo (esto es muy importante) de forma específica para un antígeno concreto, sirviendo como “alertas” para que las células inmunes neutralizadoras de amenazas puedan desencadenar una respuesta de eliminación lo suficientemente rápida y efectiva como para disolver el ataque antes de que el germen tenga tiempo de infectarnos.
Pero para que esto suceda, tenemos que tener anticuerpos para ese antígeno. Y no nacemos con ellos. Los vamos desarrollando a medida que nos exponemos a ellos. De ahí que, cuando entramos en contacto por primera vez con un germen, es muy probable que nos haga enfermar, pues el cuerpo nunca había “visto” sus antígenos y no tiene anticuerpos contra él. Así pues, tiene que perder tiempo analizándolo y sintetizando los anticuerpos específicos para él.
Un tiempo que aprovecha el germen para hacernos enfermar. Pero tras esta primera exposición, el sistema inmune se quedará con la “receta” de estos anticuerpos. De este modo, cuando haya una segunda y posteriores exposiciones, cuando vea ese mismo antígeno, no perderá tiempo. Buscará entre los archivos y producirá en masa ese anticuerpo para que la respuesta sea veloz, sin dar tiempo a que nos provoque daños.
De hecho, tener inmunidad frente a un patógeno es, en esencia, tener anticuerpos específicos contra sus antígenos. Y es que la inmunidad adaptativa se basa precisamente en esto, en la posibilidad de sintetizar y producir en masa anticuerpos contra un antígeno portado por un germen específico. La inmunidad llega después de la primera exposición o sin tan solo una primera; pues las vacunas, que tienen en los antígenos su principio activo, nos hacen tener un stock de anticuerpos contra un patógeno sin necesidad de haber sufrido una verdadera exposición al mismo.
- Te recomendamos leer: “Las 5 diferencias entre antígeno y anticuerpo”
¿Qué tipos de inmunoglobulinas existen?
Tras esta extensa pero necesaria introducción para comprender qué son y cómo funcionan los anticuerpos, estamos más que preparados para analizar cómo se clasifican estas moléculas que componen los pilares de la inmunidad adaptativa y de las respuestas inmunes ante la presencia de una amenaza portadora de antígenos. Veamos, pues, qué tipos de anticuerpos existen.
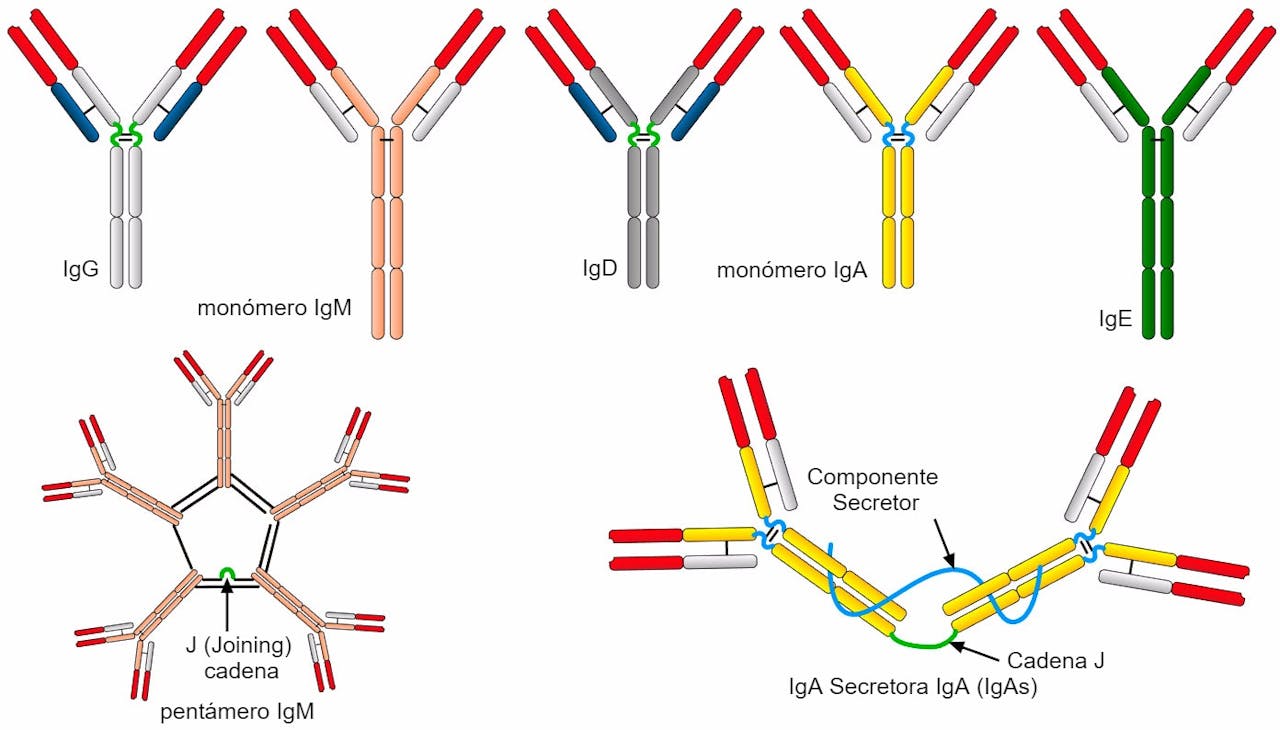
1. Inmunoglobulinas A (IgA)
Las inmunoglobulinas A son los anticuerpos predominantes en las secreciones mucosas del organismo, es decir, en el recubrimiento de las vías respiratorias, las paredes del sistema digestivo, las vías genitourinarias, la saliva, la leche materna, las lágrimas, el calostro…
Su principal función a nivel inmunitario es impedir que los patógenos penetren en el plasma, sirviendo como barreras protectoras para evitar que se anclen a las mucosas donde están presentes. Su masa molecular se encuentra entre las 170.000 y 720.000 daltons y su concentración en el suero es de entre 90 y 420 mg por cada 100 ml.
- Te recomendamos leer: “Los 8 tipos de células del sistema inmune (y sus funciones)”
2. Inmunoglobulinas G (IgG)
Las inmunoglobulinas G son las más abundantes en el organismo, representando cerca del 80% de los anticuerpos totales. Presentes en los fluidos internos del cuerpo (sangre, líquido cefalorraquídeo y líquido peritoneal), su principal función a nivel inmune es la de brindarnos protección contra las infecciones víricas y bacterianas. En otras palabras: darnos inmunidad.
Se trata del anticuerpo más pequeño, con una masa molecular de unos 150.000 daltons, pero, como hemos dicho, el más abundante, con una concentración de entre 600 y 1.800 mg por cada 100 ml. Es el único anticuerpo capaz de atravesar la placenta, siendo, pues, esencial para la transferencia de inmunidad de la madre al feto. Su vida media es de unos 25 días y son totalmente esenciales para, una vez ya los tenemos entre nuestros archivos de forma específica contra un patógeno, evitar que este nos haga enfermar en posteriores exposiciones.
3. Inmunoglobulinas M (IgM)
Las inmunoglobulinas M, que representan el 6% del total, son anticuerpos que se encuentran principalmente en la sangre y en la linfa, un líquido transparente que circula por los vasos linfáticos y que porta principalmente glóbulos blancos. Se trata del primer anticuerpo que fabrica el cuerpo para combatir una infección, algo que se comprende cuando descubrimos que son las inmunoglobulinas evolutivamente más antiguas.
Es también el anticuerpo más grande, con un peso molecular de unos 950.000 daltons, algo que se multiplica por su capacidad de formar complejos por unión de 5 moléculas de IgM, algo que permite a estos anticuerpos estimular la lisis (destrucción) de bacterias y de virus, así como la opsonización de antígenos, es decir, de marcar a los antígenos para que los fagocitos (un tipo de células inmunes) ingieran a los gérmenes portadores de los mismos.

4. Inmunoglobulinas E (IgE)
Unos anticuerpos que aquellos que tengan alergias conocerán muy bien. Las inmunoglobulinas E son anticuerpos que se encuentran en pequeñas cantidades en la sangre, excepto en personas alérgicas o en pacientes que están sufriendo una infección parasitaria. Y es que estando presente principalmente en piel, pulmones y membranas mucosas, las IgE están implicadas en las reacciones de hipersensibilidad a un alérgeno (estimulando la liberación de histamina y, por tanto, los síntomas de un ataque de alergia), así como en la protección frente a los gusanos parasitarios.
Su peso molecular es de unos 190.000 daltons, están implicados, como vemos, principalmente en las respuestas inflamatorias y su concentración, en condiciones normales (en casos de alergias o infecciones por helmintos parásitos se incrementa notablemente), es de entre 0,01 y 0,1 mg por cada 100 ml.
- Te recomendamos leer: “Las 10 alergias más comunes: causas, síntomas y tratamiento”
5. Inmunoglobulinas D (IgD)
Dejamos para el final el tipo de anticuerpo menos estudiado y cuyas funciones son menos conocidas. Las inmunoglobulinas D se encuentran en pequeñas cantidades en la sangre y es el principal componente de la superficie de los linfocitos B maduros, algo que sugiere que podría ser importante como receptor de antígenos durante la respuesta inmune. Del mismo modo, se cree que podría estimular la activación y la supresión de la actividad de estos linfocitos, pero su función exacta sigue sin estar clara.
Sea como sea, lo que sí sabemos es que es especialmente susceptible a la proteólisis (degradación de proteínas), que su peso molecular es de unos 185.000 daltons y que su concentración en el plasma sanguíneo rara vez representa más del 1% de los anticuerpos circulantes, con la excepción de los pacientes con mieloma múltiple, quienes, por motivos que siguen sin estar claros, presentan concentraciones muy elevadas relativamente hablando.