El Universo es pura química. Absolutamente todos los cambios que se producen en la naturaleza, desde las reacciones de fusión nuclear que ocurren en el corazón de las estrellas del Cosmos hasta los procesos fotosintéticos de las plantas, pasando por cómo nuestras células obtienen energía de los alimentos o los mecanismos industriales para producir alimentos, responden a la química.
Y es que todo en el Universo está formado por átomos, los cuales se estructuran para formar moléculas. Pero estas uniones no son eternas. Las moléculas pueden romper sus enlaces, así como intercambiarse átomos. Todo esto hace que, en la naturaleza, todo esté en constante cambio.
Y estos mecanismos mediante los cuales una sustancia transforma su estructura molecular para convertirse en una nueva sustancia con propiedades distintas constituyen lo que se conoce como reacción química. Pero no todas son iguales. Ni mucho menos.
Por ello, en el artículo de hoy veremos, de forma completa y concisa, cómo estas reacciones químicas se clasifican en diferentes tipos dependiendo de sus características, de las sustancias involucradas y de si liberan o consumen energía.
- Te recomendamos leer: “Los 3 tipos de rutas metabólicas (y ejemplos)”
¿Qué es una reacción química?
Una reacción química es todo aquel proceso termodinámico en el que unos reactivos transforman su estructura molecular y sus enlaces para generar un producto, es decir, una sustancia con unas propiedades distintas a la inicial.
Que sea un proceso termodinámico implica que estas reacciones químicas están basadas en el flujo tanto de temperatura como de energía, pues es precisamente esto lo que estimula que la estructura química y los enlaces de los reactivos se vean alterados. Y cuando sucede este cambio, la sustancia química se convierte en una nueva.
En este sentido, una reacción química puede entenderse como el conjunto de cambios que sufre la materia de una sustancia en lo que a ordenamiento de sus átomos (y de los enlaces entre ellos) se refiere, siendo indispensable un contacto entre dos (o más) sustancias a través de las cuales haya este flujo de temperatura y energía. Sin contacto entre compuestos químicos distintos, no hay reacción posible.
La materia no puede crearse ni destruirse. Por lo tanto, las reacciones químicas se basan simplemente en un flujo de transformación de la materia. No se crea de nuevo nunca. Solo se va transformando. Y esto es suficiente para mantener el equilibrio no solo en nuestra naturaleza, sino en el Universo.
Y es que como hemos dicho, las reacciones químicas, a pesar de que puedan pasar desapercibidas, están sucediendo continuamente en todas partes. En los platos que cocinamos, en el aire que respiramos, en nuestras células, en la tierra, en los mares, en las estrellas… Todo es química.
¿Cómo se clasifican las reacciones químicas?
Como hemos dicho, una reacción química es un proceso termodinámico (hay un flujo de temperatura y de energía) en el que unos reactivos reordenan sus átomos y enlaces para dar como producto una sustancia con propiedades distintas. Ahora bien, el abanico de procesos que cumplen con esta descripción es, prácticamente, infinito.
Por ello, uno de los mayores logros de la Química ha sido clasificar las reacciones químicas en distintas familias con el objetivo de comprender la naturaleza de las mismas, así como el de encontrar aplicaciones. Nosotros hemos rescatado las distintas clasificaciones propuestas históricamente, por lo que podrás encontrar los distintos tipos de reacciones de acuerdo a varios parámetros (puedes quedarte con el que mejor se adapte a lo que necesitas): según el flujo de energía, según la transformación de la materia, según su velocidad, según su sentido, según la partícula que se transfiere y según la naturaleza de los reactivos. Vamos allá.
1. En función del flujo de energía
Seguramente, el parámetro más importante. Como hemos mencionado, las reacciones químicas son procesos termodinámicos, lo que implica que debe haber una transferencia de energía. Y en función tanto del tipo de energía (calor, luz o electricidad) como de su flujo (si la reacción consume energía o la libera) estaremos ante uno de los siguientes tipos.
1.1. Reacciones endotérmicas
Las reacciones químicas endotérmicas son aquellas que consumen energía térmica. Es decir, para que sucedan, absorben calor del medio externo. No liberan energía, sino que tienen que consumirla y gastarla. Todas las reacciones en las que el producto es molecularmente más complejo que el reactivo son endotérmicas.
1.2. Reacciones exotérmicas
Las reacciones químicas exotérmicas son aquellas que liberan energía térmica. Es decir, cuando suceden, liberan energía en forma de calor al medio externo. No consumen calor, sino que la emanan. Todas las reacciones en las que el producto es molecularmente más sencillo que el reactivo son exotérmicas.

1.3. Reacciones endoluminosas
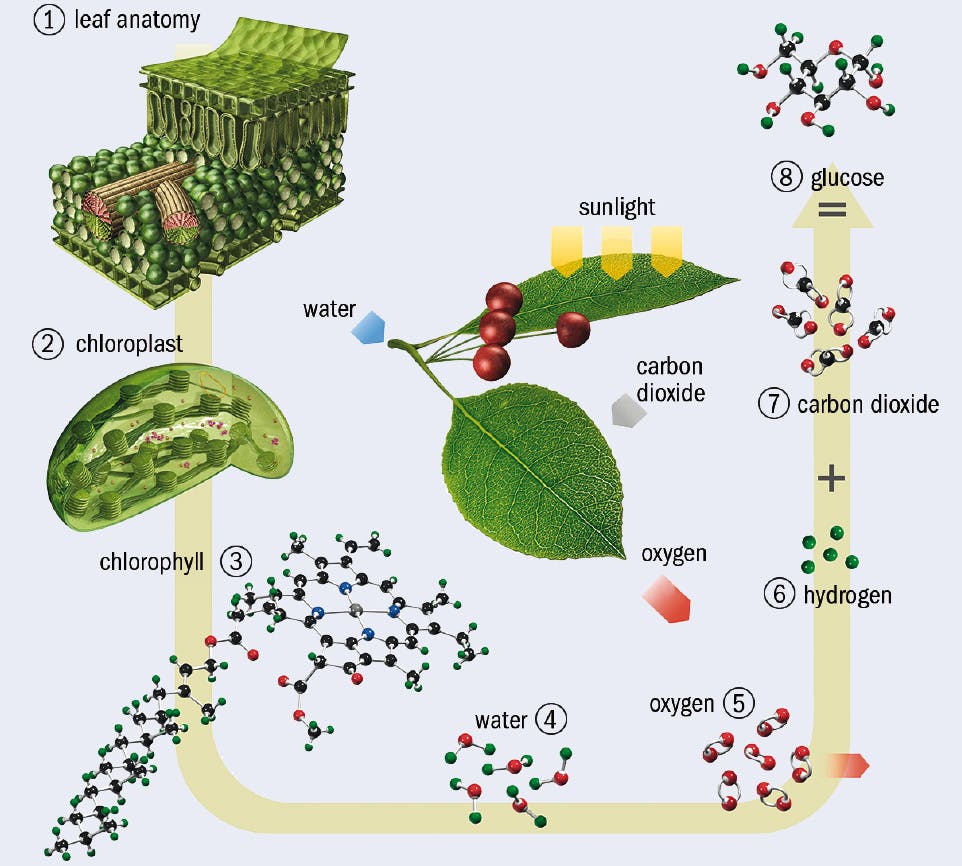
Las reacciones químicas endoluminosas son aquellas que consumen energía lumínica. Es decir, para que sucedan, deben captar la luz del medio. Es gracias a esta luz que obtienen la energía necesaria para convertir los reactivos sencillos en productos más complejos. El más claro ejemplo de ello es la fotosíntesis.
- Para saber más: “Fotosíntesis: qué es, cómo se realiza y sus fases”
1.4. Reacciones exoluminosas
Las reacciones químicas exoluminosas son aquellas que liberan energía lumínica. Es decir, la conversión del reactivo en el producto no consume energía, sino que la emana pero no en forma de calor (aunque también puede hacerlo), sino en forma de luz. Todas las reacciones químicas que brillan son de este tipo, incluidos los fenómenos bioluminiscentes de determinados animales.
1.5. Reacciones endoeléctricas
Las reacciones químicas endoeléctricas son aquellas que consumen energía eléctrica. Es decir, para convertir un reactivo sencillo en un producto complejo, se requiere de un aporte de electricidad. Es la descarga eléctrica la que da la energía necesaria para que se lleve a cabo.
1.6. Reacciones exoeléctricas
Las reacciones químicas exoeléctricas son aquellas que liberan energía eléctrica. Es decir, el paso de un reactivo complejo a un producto molecularmente más simple provoca la liberación de electricidad. Cuando la reacción química tiene lugar, se desprende energía eléctrica.
2. En función de la transformación de la materia
Junto con el parámetro anterior, uno de los más importantes. Además del factor termodinámico, hemos dicho que una reacción química es un proceso en el que tiene lugar un reordenamiento de los átomos y los enlaces de las especies químicas involucradas. Pues bien, dependiendo de cómo sea esta transformación de la materia, estaremos ante uno de los siguientes tipos.
2.1. Reacciones de síntesis
También conocidas como reacciones de combinación, las reacciones químicas de síntesis son aquellas en las que el reordenamiento de la materia consiste en que dos reactivos químicos se unen para originar un producto distinto. Por lo tanto, dos reactivos (A y B) se combinan para dar lugar a un producto C.
2.2. Reacciones de descomposición simple
Las reacciones químicas de descomposición simple son aquellas en las que el reordenamiento de la materia consiste en que un reactivo se degrada en sus componentes. En otras palabras, una sustancia química se descompone en sus elementos más simples. Es el paso inverso al anterior tipo. Por lo tanto, un reactivo A se desdobla en sus componentes B y C (aunque pueden ser más).
2.3. Reacciones de descomposición por reactivo
Las reacciones químicas de descomposición por reactivo son iguales a las anteriores en el sentido que un reactivo se desdobla en sus componentes, aunque en este caso requiere de la presencia de un reactivo secundario que haga posible esta descomposición. Un reactivo A solo puede descomponerse en B y C cuando forma un complejo AX (donde X es el reactivo secundario) que, ahora sí, puede desdoblarse en dos sustancias BX y CX.
2.4. Reacciones de sustitución
Las reacciones químicas de sustitución, también conocidas como reacciones de desplazamiento, son aquellas en las que el reordenamiento de la materia consiste en que un elemento pasa a ocupar el puesto de otra sustancia, dejándola libre. Puede resultar complejo, pero lo cierto es que es bastante sencillo. Tenemos una mezcla con dos reactivos: un complejo AB y una sustancia C libre. Pues bien, la reacción de sustitución consiste en que C pasa a ocupar el sitio de B, haciendo que cambie el complejo y que B quede libre. Es decir, nos quedamos con un complejo AC y una sustancia B libre.
2.5. Reacciones de doble sustitución
Las reacciones químicas de doble sustitución (o de doble desplazamiento) son lo mismo que los anteriores, aunque en este caso no hay sustancias libres en ningún momento. Por lo tanto, el reordenamiento de la materia ocurre entre los componentes de dos complejos químicos. De nuevo, se entiende mejor con un ejemplo. Tenemos una mezcla con dos reactivos: un complejo AB y otro complejo CD. Pues bien, básicamente hay un “cambio de pareja” y pasamos a tener un complejo AC y un complejo BD.
2.6. Reacciones nucleares
Las reacciones nucleares merecen una mención individual. Y es que a diferencia de las anteriores, donde simplemente hay un reordenamiento de los átomos, enlaces y moléculas, en este caso estamos alterando la estructura del núcleo del átomo, por lo que hay un cambio de elemento químico.
Pueden ser de dos tipos: reacciones de fisión nuclear (los protones del núcleo se separan para dar lugar a dos núcleos más pequeños) o de fusión nuclear (los núcleos de dos átomos se unen para dar lugar a un núcleo más grande).

3. En función de su velocidad
La velocidad de las reacciones químicas es increíblemente variable. Desde reacciones que se completan en pocos segundos hasta otras que requieren de años para culminar. En esta línea, tenemos las reacciones lentas y las rápidas.
3.1. Reacciones lentas
Las reacciones químicas lentas son aquellas que suceden a una velocidad baja. No hay demasiado consenso sobre cuánto tiempo tiene que durar su desarrollo como para que tenga esta etiqueta, pero podemos pensar en ellas como aquellas que no podemos sentarnos a ver cómo suceden. Un ejemplo de ello es la oxidación del hierro.

3.2. Reacciones rápidas
Las reacciones químicas rápidas son aquellas que suceden a una velocidad alta. De nuevo, no hay un consenso claro. Pero tenemos aquellas que podemos sentarnos a ver cómo suceden (pero con algunas cuidado) e incluso otras (como la fisión nuclear) que se completan en apenas milésimas de segundo.
4. En función de su sentido
Las reacciones químicas pueden clasificarse en dos grandes grupos en función de si los reordenamientos moleculares que han sucedido son reversibles o no. Esto es de suma importancia en el mundo de la Química. Veámoslos.
4.1. Reacciones reversibles
Las reacciones químicas reversibles son aquellas que pueden darse en ambos sentidos. En otras palabras, igual que los reactivos se convierten en productos, estos productos pueden volver a transformarse en los reactivos iniciales.
4.2. Reacciones irreversibles
Las reacciones químicas irreversibles, por su parte, son aquellas que solo pueden darse en un sentido. Es decir, cuando los reactivos se han convertido en los productos, estos productos no pueden volver a transformarse en los reactivos iniciales.

5. En función de la partícula que se transfiere
En las reacciones químicas, siempre hay alguna transferencia de partícula subatómica (excepto las nucleares, que ya hemos visto que son otro mundo). Dependiendo de si esta partícula es un protón o un electrón, estaremos ante uno de los siguientes tipos.
5.1. Reacciones redox
Las reacciones redox, también conocidas como reacciones de oxidación-reducción, son aquellas en las que se produce una transferencia de electrones. Es decir, el reordenamiento de la materia se basa en un flujo de electrones entre distintas sustancias químicas. Siempre hay un agente oxidante (quien roba electrones) y un agente reductor (el que pierde los electrones), dando lugar así a unos productos iónicos (que ya no son eléctricamente neutros): un anión con carga negativa (porque ha ganado electrones) y un catión con carga positiva (porque ha perdido electrones).
- Para saber más: “Potencial redox: definición, características y aplicaciones”
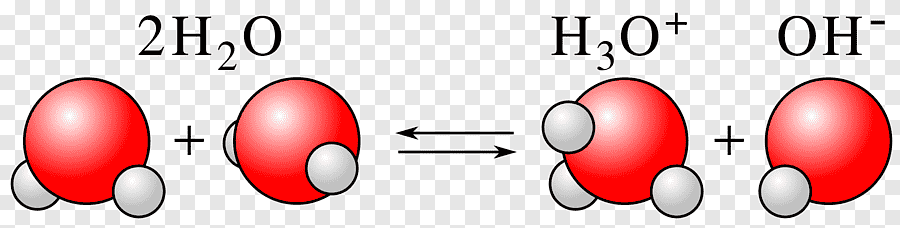
5.2. Reacciones de ácido-base
Las reacciones de ácido-base son aquellas en las que se produce una transferencia de protones, entendidos como cationes del hidrógeno (H+), cuando un ácido (pH bajo) y una base (pH alto) reaccionan para producir una sal, que en química hace referencia a cualquier sustancia originada como producto de este tipo de reacción. Sea como sea, lo importante es que en la reacción tenemos un ácido que transfiere protones a una base.
6. En función de la naturaleza de los reactivos
Las dos principales ramas de la Química son la Química orgánica y la inorgánica. Por ello, es importante diferenciar las reacciones en función de su naturaleza. Veamos, pues, las particularidades de cada una de ellas.
6.1. Reacciones inorgánicas
Las reacciones químicas inorgánicas son todas aquellas en las que los reactivos (y, por lo tanto, los productos) son de naturaleza inorgánica. En este sentido, son reacciones donde las sustancias no contienen carbono como elemento. Son, pues, reacciones químicas no vinculadas a la vida.
6.2. Reacciones orgánicas
Las reacciones químicas orgánicas son todas aquellas en las que los reactivos (y, por lo tanto, los productos) son de naturaleza orgánica. En este sentido, son reacciones donde las sustancias contienen siempre el carbono como elemento central. Son, pues, reacciones químicas vinculadas de forma más o menos directa con la vida.