La Química es una de las ciencias más importantes del mundo porque, básicamente, todo lo que nos rodea es química. Desde las reacciones de fusión nuclear que tienen lugar en el corazón de las estrellas hasta el proceso a través del cual nuestras células consumen energía, pasando por cómo las plantas hacen la fotosíntesis o cómo cocinamos nuestros platos, todo es química.
Y en este contexto, de las millones de sustancias químicas distintas, hay algunas más conocidas y otras menos conocidas. Hoy, en este artículo, nos centraremos en una que quizás no es tan famosa como otras pero que, sin duda, desde el punto de vista químico, es asombrosa: el ácido disulfúrico.
Con importancia en la industria del petróleo, en la manufactura de explosivos, en la fabricación de plásticos, en la síntesis de fertilizantes, en el tratamiento del acero, en la producción de baterías, en la síntesis de otros ácidos y sulfatos, en la industria de la madera, en las fábricas textiles, etc, este ácido disulfúrico está presente en más ámbitos de los que creemos.
Y si quieres conocer sus características, propiedades químicas, nomenclatura, usos y funciones, has llegado al lugar adecuado. En en el artículo de hoy exploraremos, de la mano de las más prestigiosas publicaciones científicas en el mundo de la Química, las particularidades más interesantes del ácido disulfúrico. Vamos allá.
- Te recomendamos leer: “Las 10 sustancias más ácidas del mundo”
¿Qué es el ácido disulfúrico, óleum o ácido pirosulfúrico?
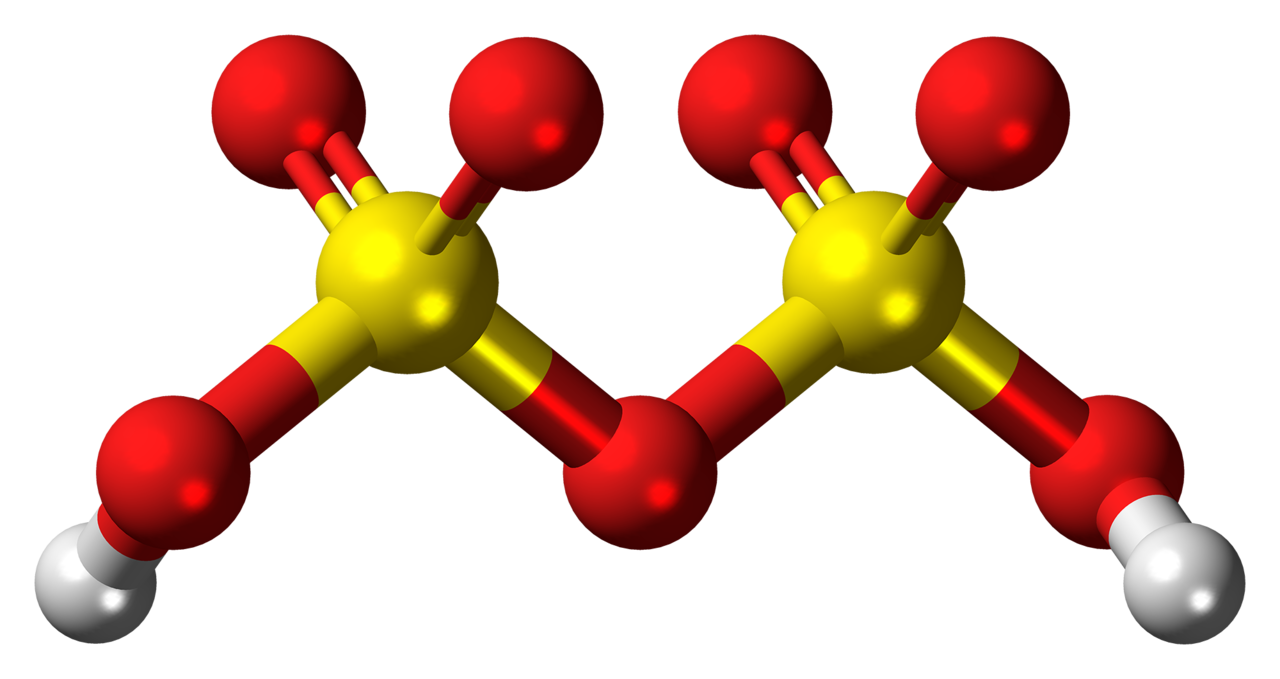
El ácido disulfúrico, óleum o ácido pirosulfúrico es un oxácido, es decir, un ácido que contiene oxígeno en su composición química. Más concretamente, es un oxácido del azufre cuya fórmula química es H2S2O7, por lo que está compuesto por dos átomos de hidrógeno (H), dos de azufre (S) y siete de oxígeno (O).
El ácido disulfúrico es el componente principal del ácido sulfúrico fumante y tiene una masa molar de 178,13 g/mol y un punto de fusión (paso de sólido a líquido) de 36 °C, por lo que a temperatura ambiente, este ácido pirosulfúrico es sólido.
Se conoce como óleum debido a su consistencia aceitosa y a su color cristalino, aunque a veces puede ser amarillenta o incluso café oscuro (depende de la concentración de SO3). Se trata de un ácido anhidro, es decir, que no contiene agua y que es difícil aislarlo de forma pura.
En este sentido, el ácido disulfúrico es una forma “densa” del ácido sulfúrico que se forma cuando una molécula de H2SO4 reacciona con una de SO3, dando lugar así a este ácido disulfúrico que puede formularse como H2S2O7 o, debido a la reacción de formación, como H2SO4·SO3.
En lo que a su estructura molecular se refiere, en ambos extremos nos encontramos con cada grupo hidroxilo. Y por efecto inductivo de los átomos de oxígeno, los hidrógenos incrementan su carga parcial positiva, algo que explica que presente una acidez todavía más alta que la del ácido sulfúrico.
Una solución de ácido disulfúrico puede tener distintas propiedades en función del porcentaje de ácido sulfúrico que contenga y de su conformación. Aun así, es necesario recalcar que, a pesar de que parezca muy interesante a nivel de laboratorio, lo cierto es que rara vez se utiliza en estos ambientes y sus usos van destinados a otros marcos que comentaremos más adelante.
Propiedades del ácido disulfúrico
El ácido disulfúrico, óleum o ácido pirosulfúrico se obtiene a través de lo que se conoce como “proceso de contacto”, que consiste en la adición de grupos oxígeno al azufre (SO3) y luego en la disolución en concentrado de ácido sulfúrico (H2SO4). Como vemos, la Química tiene mucho de Matemáticas.
De todos modos, es importante tener en cuenta que sus propiedades no están demasiado bien descritas debido a las dificultades que presenta aislarlo de forma pura. Y es que en este óleum pueden haber otros compuestos con fórmulas químicas similares pero no exactamente las del ácido disulfúrico.
Sea como sea, en un estado de casi pureza total, se trata de un sólido cristalino fumante (que es inestable) a temperatura ambiente que se funde a los 36 °C, aunque este punto de cambio de fase depende de la pureza. Del mismo modo, dependiendo de la concentración de SO3, puede ser amarillento e incluso de color café oscuro.
Otra de sus propiedades es la capacidad de formar sales disulfatos, también conocidas como pirosulfatos. Un ejemplo de ello es lo que sucede con el hidróxido de potasio (KOH), sustancia con la que reacciona este ácido disulfúrico para dar lugar al pirosulfato de potasio (K2S2O7).
Tiene también dos iones H+ que pueden neutralizarse con una base fuerte y, como hemos comentado anteriormente, una masa molar de 178,13 g/mol. Químicamente, se considera un anhídrido del ácido sulfúrico, pues, debido a la condensación entre dos moléculas de ácido, pierde una molécula de agua.
Y aunque se conoce como ácido pirosulfúrico debido a que en su formación interviene el calor, la IUPAC (Unión Internacional de Química Pura y Aplicada) recomienda sencillamente la nomenclatura de ácido disulfúrico. Sea como sea, su prefijo -ico se debe a que el átomo de azufre tiene una valencia de +6.
- Te recomendamos leer: "Los 20 tipos de reacciones químicas (y sus características)"

Funciones y usos del ácido disulfúrico
Ahora que ya hemos entendido la naturaleza química del ácido disulfúrico y sus propiedades, estamos más que preparados para ver qué aplicaciones tiene esta sustancia a nivel práctico. Analicemos, pues, las funciones y usos del ácido disulfúrico.
1. Síntesis de ácido sulfúrico
Uno de sus usos más importantes es el de la producción de ácido sulfúrico. Sí, puede sonar contraintuitivo, pues hemos visto que el ácido disulfúrico se obtiene del ácido sulfúrico, pero también puede ser útil para la síntesis de este ácido sulfúrico (H2SO4).
Y es que si adicionamos agua a la disolución, el ácido disulfúrico reacciona formando más ácido sufúrico y aumentando su concentración. Si todavía queda agua, se añade más SO3, que reacciona con el ácido sulfúrico para producir ácido disulfúrico, que puede volver a hidratarse para así secar el ácido sulfúrico. Este proceso puede repetirse varias veces hasta obtener un ácido sulfúrico aislado y con una concentración del 100%.
2. Almacén de ácido sulfúrico
Un uso muy interesante es el de que puede servir como almacén más seguro y práctico de ácido sulfúrico. Gracias a su propiedad de ser sólido a temperatura ambiente, es una buena forma de “guardar” el ácido sulfúrico y de transportarlo de forma segura. Luego, cuando sea necesario tener el ácido sulfúrico como tal, se realiza el proceso anterior para obtenerlo en una concentración del 100%.
Esto es muy interesante para el transporte del ácido sulfúrico en camiones con tanques, entre diversas industrias y entre refinerías de aceites. Evidentemente, debe realizarse de forma extremadamente cuidadosa, pues un sobrecalentamiento del material puede provocar problemas.
Es más seguro porque puede transportarse de forma sólida y, además, el ácido disulfúrico es menos corrosivo con los metales que el sulfúrico, pues no hay moléculas libres de agua que puedan atacar a las superficies. Por todo esto, el ácido disulfúrico es muy interesante para el almacén y transporte de lo que puede convertirse, por la reacción que hemos analizado antes, en ácido sulfúrico.
3. Sulfonación de sustancias químicas
La sulfonación es toda aquella reacción química en la que se introduce un grupo sulfónico (SO2OH) a una sustancia química, obteniendo así un ácido sulfónico. Esto es muy interesante en la industria textil, pues el ácido disulfúrico se utiliza para estimular la sulfonación de los compuestos químicos colorantes. La adición del grupo sulfónico hace que pierdan un protón ácido y que puedan anclarse a los polímeros de la fibra téxtil y así mejorar el proceso de coloración.

4. Intermediario de reacciones químicas
Más allá de esta sulfonación, el ácido disulfúrico puede utilizarse como intermediario de distintas reacciones químicas. De hecho, su acidez se aprovecha para lograr la segunda nitración (adición de grupos NO2) en las sustancias químicas con anillos aromáticos, especialmente con el nitrobenceno, un líquido aceitoso tóxico. Su primera nitración ocurre en presencia de ácido nítrico, pero para la segunda se necesita un reactivo más fuerte como este ácido disulfúrico.
Y su poder corrosivo y agresiva reactividad puede ser interesante en distintas reacciones de química orgánica. Del mismo modo, también se utiliza el ácido disulfúrico para la obtención del trinitrotolueno, un compuesto químico explosivo y parte de varias mezclas explosivas, al promover la oxidación del anillo del dinitrotolueno y la adición de un tercer grupo nitro.
5. Usos en la industria
Por último, terminamos con su uso industrial. El ácido disulfúrico tiene una gran importancia, gracias a sus propiedades químicas y/o poder corrosivo, como hemos comentado en la introducción, en la industria del petróleo, en la manufactura de explosivos (acabamos de analizar su papel en la obtención de trinitrotolueno), en el tratamiento químico del acero, en la fabricación de distintos tipos de plásticos, en la producción de baterías, en la síntesis de otros ácidos (incluido, por supuesto, el sulfúrico) y de sulfatos (por la sulfonación), en las fábricas textiles (especialmente en lo que tiene que ver con unión de colorantes a polímeros textiles), en la síntesis de fertilizantes y en la industria de la madera y el papel. Como vemos, sus usos industriales tienen impacto en casi todos los ámbitos de nuestra vida.